Ступенчатое включение: дозозависимый эффект антидепрессантов
Дозозависимое действие велаксина, селективного ингибитора обратного захвата серотонина и норадреналина, позволяет корректировать лёгкие депрессивные расстройства, купировать состояния с психомоторной заторможенностью и устранять психотические проявления. | |
partners Ключевые слова / keywords: Антидепрессанты, Велаксин, Венлафаксин, Депрессивные расстройства, Дофаминергическая терапия, Ингибиторы обратного захвата серотонина и норадреналина, Норадренергическая система, Психоневрология, Серотонинергическая система, Antidepressants, Velaxin, Venlafaxine, Depressive disorders, Dopaminergic therapy, Serotonin and norepinephrine reuptake inhibitors, Noradrenergic system, Neuropsychiatry, Serotonergic system
VEL 05. 11.2020/11
11.2020/11
Мультитаргетный механизм действия является преимуществом для препарата с антидепрессивным действием. Дело в том, что сегодня, с ростом распространённости депрессии и необходимости её амбулаторного лечения, увеличивается потребность в антидепрессантах (АД) с более мощным и управляемым эффектом. Усилить эффективность антидепрессантов удалось путем расширения их нейрохимического профиля, что стало основой синтеза нового поколения антидепрессантов – селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН).
На отечественном рынке представителем СИОЗСиН является Велаксин® (венлафаксин). Велаксин® воздействует на три системы нейромедиаторов: серотонин (отвечает за фон настроения), норадреналин (активирует, концентрирует внимание) и дофамин (повышает мотивацию) [1]. Благодаря широкому терапевтическому диапазону доз, ингибиция обратного захвата моноаминов происходит не единовременно, а последовательно, в зависимости от концентрации активной молекулы препарата.
В соответствии с концепцией ступенчатого влияния на нейромедиаторные системы, венлафаксин последовательно проявляет серотонинергические, норадренергические и дофаминергические эффекты [2]. При включении новых нейрохимических «мишеней» венлафаксина наблюдается расширение спектра его клинической эффективности [3]. Так, в дозе 75-125 мг венлафаксин проявляет серотонинергическое действие. Это означает, что  ) [1]. Соответственно, первые два эффекта широко применяются в амбулаторной практике, а последний подходит для использования в условиях стационара.
) [1]. Соответственно, первые два эффекта широко применяются в амбулаторной практике, а последний подходит для использования в условиях стационара.
Дозозависимая нейрофармакология Велаксина® выгодно отличает его от СИОЗС, у которых ожидаемыми эффектами являются только серотонинергические [2]. В отдельных исследованиях
- Инструкция по медицинскому применению препарата Велаксин® капсулы ЛСР 000030 от 24.05.2017.
- Аведисова А.
- Иванец Н.Н., Кинкулькина М.А., Тихонова Ю.Г. и др. Венлафаксин при лечении умеренных и тяжелых депрессий: пути повышения эффективности терапии. 2015. №1. Т. 115. С. 30-34.
- Tylee A, Beumonl G, Bowden М, Reynolds A. A double blind, randomised, 12 week comparison study of the safety and efficacy ofvenlafaxine and fluoxetine in moderate to severe major depression in general practice. Primary Care Psychiat 1997; 3: 51-8.
- Lecrubier Y, Moon C, Shifano F et al. Double blind, randomised, placebo-controlled comparison of venlafaxine and imipramine in general practice patients with mild to moderate depression. Acta Psychiatrica Scandinavica (in press).
Материал предназначен для медицинских работников.
Клиническая эффективность и переносимость препарата венлафаксин (Велаксин) при лечении умеренной и тяжёлой депрессии :: ТРУДНЫЙ ПАЦИЕНТ
С. Н. Мосолов, Е.Г. Костюкова, А.В. Городничев, И.В. Тимофеев, М.Я. Ладыженский, О.В. Сердитов
Н. Мосолов, Е.Г. Костюкова, А.В. Городничев, И.В. Тимофеев, М.Я. Ладыженский, О.В. Сердитов
Московский НИИ психиатрии Росздрава
Терапия расстройств депрессивного спектра, начиная с 60-х годов прошлого века и до настоящего времени, остается сложной и актуальной проблемой. Несмотря на многообразие имеющихся в арсенале психиатров антидепрессантов, существует большая группа пациентов, у которых известные препараты оказываются неэффективны или вызывают нежелательные явления. В связи с этим активно продолжаются исследования патогенеза депрессии и механизмов действия антидепрессантов, что позволяет синтезировать новые эффективные препараты с улучшенным профилем переносимости и более мощным механизмом действия.
Венлафаксин является первым тимоаналептиком III поколения (селективным ингибитором обратного захвата серотонина и норадреналина – СИОЗСН), вслед за которым появилась целая группа таких препаратов (милнаципран, дулоксетин). Нельзя не отметить, что венлафаксин – самый изученный и наиболее часто назначаемый препарат из группы СИОЗСН и используется во многих исследованиях (в целях доказательства эффективности новых антидепрессантов) как эталонный.
В последнее десятилетие накопились убедительные данные о высокой эффективности трициклических антидепрессантов (ТЦА) по сравнению с СИОЗС при лечении тяжёлых, в т. ч. меланхолических депрессий. Известны результаты двух независимых исследований [1, 2], в которых сравнивали эффективность кломипрамина, циталопрама и пароксетина. Терапевтический ответ при лечении кломипрамином оказался в 2 раза выше, чем у циталопрама (60 и 30 %). Сходные результаты отмечены при сравнении кломипрамина и пароксетина. Превосходство ТЦА в терапии тяжёлых депрессивных состояний также выявлено в двух мета-анализах, проведенных Anderson [3, 4]. Они подтвердили, что ТЦА с широким, неселективным механизмом действия (амитриптилин и кломипрамин) более эффективны, чем СИОЗС. В нашей стране сходные данные были получены А.Б. Смулевичем и С.Н. Мосоловым на материале открытых исследований [5, 6].
Результаты приведенных исследований, а также клиническая практика привели к идее усилить эффективность антидепрессантов путем расширения нейрохимического приложения, что стало основой синтеза нового поколения антидепрессантов, а именно: 1) препараты «двойного» действия, по сравнению c селективными антидепрессантами, более эффективны и имеют более широкий спектр клинического действия; 2) по сравнению с ТЦА антидепрессанты «двойного» действия более безопасны; 3) антидепрессанты «двойного» действия имеют ряд особенностей и специфических эффектов. Эти положения, как показала клиническая практика, полностью реализовались в процессе применения антидепрессанта «двойного» действия венлафаксина.
Эти положения, как показала клиническая практика, полностью реализовались в процессе применения антидепрессанта «двойного» действия венлафаксина.
Венлафаксин, обладая широким терапевтическим диапазоном доз, последовательно включает в спектр своей нейрохимической активности серотонинергические, норадренергические и дофаминергические эффекты. Так, в дозе 75-125 мг венлафаксин проявляет серотонинергическое действие, при повышении дозы до 225 мг – включается норадренергическое, а дальнейшее увеличение дозы до 375 мг приводит к появлению дофаминергического эффекта. Подобная дозозависимая фармакология венлафаксина принципиально отличает этот препарат от СИОЗС, ограниченный диапазон терапевтических доз, которых сужает возможность проявления других нейрохимических эффектов кроме серотонинергических [7].
Высокая эффективность венлафаксина была продемонстрирована в сравнительных исследованиях с ТЦА. Так, сравнение венлафаксина и кломипрамина не выявило различий по антидепрессивному эффекту при несколько лучшей переносимости венлафаксина за счёт меньшей частоты холинолитических нежелательных явлений (p ≤ 0,05) [8]. Не уступает венлафаксин по эффективности амитриптилину [9] и имипрамину, хотя дозы, использованные в исследовании, были близки к максимальным (имипрамин 179 мг/сут против 183 мг/сут венлафаксина) [10].
Не уступает венлафаксин по эффективности амитриптилину [9] и имипрамину, хотя дозы, использованные в исследовании, были близки к максимальным (имипрамин 179 мг/сут против 183 мг/сут венлафаксина) [10].
Мета-анализ 19 исследований, включающих 2181 больного, показал, что к побочным эффектам венлафаксина, частота которых превышает 10 %, относятся: тошнота, головная боль, инсомния, сонливость, сухость во рту, головокружение, запоры, астения, потливость и нервозность [11]. Из них тошнота является наиболее распространенным нежелательным явлением и в 6 % случаев приводит к отмене препарата. Вместе с тем, частота возникновения этого нежелательного эффекта уменьшается на 50 % уже после 1-й недели терапии и далее – в течение всего курса лечения. Антихолинергические побочные эффекты возникают у венлафаксина в 2 раза реже, чем при применении ТЦА.
Вместе с тем, отмечено, что некоторые побочные эффекты венлафаксина являются дозозависимыми (что является прямым отражением дозозависимой фармакологии препарата). К ним с высокой определенностью относят такие серотонинергические нежелательные явления, как тошнота, инсомния и сексуальные дисфункции [12].
К ним с высокой определенностью относят такие серотонинергические нежелательные явления, как тошнота, инсомния и сексуальные дисфункции [12].
Целью настоящей работы было изучение эффективности, особенностей тимоаналептического действия и переносимости препарата венлафаксин при лечении умеренной и тяжёлой депрессии.
Исследование было открытым, несравнительным. Длительность исследования составляла 6 недель.
В исследование отбирались больные в возрасте от 18 до 65 лет с диагнозом по МКБ-10 рекуррентное депрессивное расстройство (F32.1), умеренный или тяжёлый депрессивный эпизод (F33.1 или F33.2), биполярное аффективное расстройство (F31): эпизод умеренной или тяжёлой депрессии (F31.3 и F31.4). Минимальная сумма баллов при оценке по 17-балльной шкале Гамильтона (ШГ) составляла не менее 17, а по шкале Глобального клинического впечатления (ШГКВ) – не менее 4 баллов. В исследование включались пациенты, давшие письменное информированное согласие на участие в нём. Оценивалось также качество жизни с помощью краткой шкалы качества жизни ВОЗ в начале и конце исследования.
Критериями исключения являлись период беременности и лактации у женщин; высокий суицидальный риск для амбулаторных больных; любые клинически значимые некомпенсированные заболевания почек, печени, сердечно-сосудистой, дыхательной системы, цереброваскулярные расстройства или другие серьёзные прогрессирующие соматические заболевания; органические заболевания ЦНС, любой из перечисленных методов лечения в указанные временные интервалы до начала исследования: ингибиторы МАО (включая обратимые) – 2 недели; электросудорожная терапия – 3 месяца; депо-формы нейролептиков – 4 недели.
Для больных, принимавших какие-либо психотропные препараты до начала исследования, проводился 7-дневный период «отмены»(«wash out»).
В первые две недели исследования, включая период «отмены», допускалось назначение снотворных препаратов для коррекции расстройств сна и анксиолитиков (за исключением альпразолама) при симптомах тревоги, которые могли привести к преждевременному прерыванию исследования. Далее эта сопутствующая терапия отменялась всем пациентам, за исключением тех, кто принимал бензодиазепиновые транквилизаторы длительное время до начала исследования. В исследовании не использовалась какая-либо специфическая психотерапия. Пациентам давались разъяснения относительно их состояния, включая ожидаемый эффект от применения препарата.
В исследовании не использовалась какая-либо специфическая психотерапия. Пациентам давались разъяснения относительно их состояния, включая ожидаемый эффект от применения препарата.
В ходе наблюдения выраженность депрессивной симптоматики регистрировалась с использованием Шкалы Гамильтона для депрессий (17 пунктов) (НАМ-D), Шкалы Глобального клинического впечатления (CGI) и краткой шкалы качества жизни ВОЗ. Оценка состояния больных проводилась непосредственно до начала приема препарата (0 день терапии), а затем на 4, 7, 14, 21, 28, 35, 42-й дни лечения. В эти же дни на протяжении всего исследования регистрировались все возникающие нежелательные явления (НЯ) с указанием их тяжести, времени возникновения и продолжительности. К НЯ относилось любое неблагоприятное (с медицинской точки зрения) событие, произошедшее с получавшим исследуемый препарат больным, или вне зависимости от его причинной связи с ним. Ухудшение состояния симптомов, имевшихся у больного до исследования, также регистрировалось как неблагоприятное явление.
В исследование были включены 30 пациентов, из них 26 (86,6 %) женщин и 4 (13,4 % мужчин). Средний возраст пациентов составлял 43,6 ± 2,7 года.
Длительность заболевания составляла в среднем 13,0 ± 1,9 лет, количество перенесённых прежде депрессивных эпизодов равнялось 6,6 ± 1,2. Длительность настоящего эпизода депрессии в среднем составляла 3,6 ± 1,22 месяцев. Медикаментозное лечение текущего депрессивного эпизода до начала исследования проводилось 13 (50 %) пациентам.
Исходный средний по группе показатель суммарного балла по первым 17 пунктам HAM-D составлял 21,96 ± 2,4. По CGI средний по группе показатель тяжести заболевания составлял 4,34 ± 0,48 балла.
Венлафаксин (Велаксин) назначался в однократной суточной дозе 75 мг/сут с последующим повышением дозы до 150 мг/сут в 2 приёма в течение первой недели. При недостаточной эффективности препарата доза увеличивалась до 225 мг/сут. Увеличение дозы проводилось через 3 недели после начала терапии. Средняя суточная доза венлафаксина составляла 137,5 мг/cут.
Завершило исследование 26 больных. Один пациент выбыл в связи с отказом от продолжения исследования, 2 пациента выбыли в связи с ухудшением состояния в период между 14 и 21-м днем терапии, 1 пациент выбыл в связи с нежелательными явлениями на 3-й день терапии.
Результаты исследования
При анализе данных были получены следующие результаты. Общая эффективность терапии к концу исследования по ШГ (процент больных с редукцией суммарного балла не менее чем на 50 %), составила 77 % (20 из 26 пациентов). Качественная ремиссия (≤ 7 баллов) к окончанию исследования установилась у 61 %. По шкале CGI положительный эффект (выраженное и существенное улучшение) наблюдался у 18 (69 %) пациентов.
Уже на второй неделе терапии 40 % больных оценивались как респондеры к проводимой терапии, к третьей неделе терапии 50 % являлись респондерами, а к 6-й неделе лечения их число превысило две трети от общего числа (20 из 27-74,7 %). Значительное нарастание числа респондеров к 3-й неделе терапии указывает на достаточно быстрый эффект, несколько опережающий сроки характерные для большинства антидепрессантов. Из рис. 1 видно, что прирост числа больных с положительным эффектом терапии наблюдался вплоть до окончания исследования, хотя наиболее выраженным он был между 3-й и 5-й неделями терапии, что позволяет предположить достаточно быстрое наступление эффекта в сравнении с другими антидепрессантами нового поколения, а также распространить на венлафаксин рекомендации по продолжению терапии не менее 6 недель.
Из рис. 1 видно, что прирост числа больных с положительным эффектом терапии наблюдался вплоть до окончания исследования, хотя наиболее выраженным он был между 3-й и 5-й неделями терапии, что позволяет предположить достаточно быстрое наступление эффекта в сравнении с другими антидепрессантами нового поколения, а также распространить на венлафаксин рекомендации по продолжению терапии не менее 6 недель.
Эти данные подтверждаются и анализом динамики показателей тяжести депрессии по CGI. Изменение показателя тяжести заболевания наблюдалось уже на 7-й день терапии (р Эффект терапии наступал достаточно быстро. Значение суммарного балла ШГ по группе в целом уже на 4-й день уменьшалось на 12 % и на 7-й день лечения – на 23 % (изменения статистически значимы, р ≤ 0,01) (рис. 2). В дальнейшем происходило последовательное уменьшение выраженности депрессивной симптоматики. К концу исследования суммарный балл ШГ составлял 6,9 ± 0,9 баллов, что практически, соответствует общепринятому показателю терапевтической ремиссии по ШГ и свидетельствует об отчётливом антидепрессивном действии исследуемого препарата.
Основные показатели, определяющие спектр психотропного действия антидепрессанта (пониженное настроение, психическая тревога и заторможенность), редуцировались достаточно равномерно (рис. 3), статистическая значимость изменений для каждого показателя наблюдалась уже на 7-й день терапии (р Несмотря на достаточно гармоничную редукцию тревоги и заторможенности, в первые дни преобладала редукция тревожной симптоматики, но к окончанию первой недели терапии редукция показателей выравнивалась.
Характер тимоаналептического действия наглядно подтверждается анализом коэффициента (К) соотношения редукции тревоги и заторможенности (рис. 4). Значение К, равное 1, отражает равномерную редукцию показателей ШГ «психическая тревога» и «заторможенность» и свидетельствует о сбалансированном тимоаналептическом действии препарата. Как видно из рис. 4, в начале терапии значение К было значительно больше 1, особенно начиная с 4-го дня и до 21-го дня терапии. Это означает, что в начале терапии тревога редуцировалась значительно быстрее заторможенности. В исследовании это приводило к быстрой редукции тревожной симптоматики, отсутствию необходимости дополнительного использования транквилизаторов. Однако к 4-й неделе терапии влияние венлафаксина становится сбалансированным до конца курса терапии.
В исследовании это приводило к быстрой редукции тревожной симптоматики, отсутствию необходимости дополнительного использования транквилизаторов. Однако к 4-й неделе терапии влияние венлафаксина становится сбалансированным до конца курса терапии.
Выше уже упоминалось, что венлафаксин, используемый в различных дозах, способен по-разному воздействовать на редукцию депрессивной симптоматики. Так, венлафаксин в дозе 75-150 мг/сут влияет преимущественно на серотонинергическую передачу и похож на СИОЗС. Редукция коэффициента тревога/заторможенность для группы пациентов, принимавших венлафаксин в дозах до 150 мг/сут, приведена на рисунке 5.
Как видно из рисунка 5, на 4-й день терапии препарат оказывал более выраженное редуцирующее действие на симптоматику тревоги по сравнению с его влиянием на заторможенность, однако уже к концу первой недели действие венлафаксина становилось более сбалансированным с крайне незначительным активирующим эффектом после месяца терапии.
Действие венлафаксина в дозе более 150 мг/сут на коэффициент редукции тревоги/заторможенности несколько отличается (рис. 6).
6).
Обращает на себя внимание длительное, до 3-й недели терапии, преобладание редукции тревожной симптоматики по отношению к редукции заторможенности, что оценивалось пациентами как отсутствие тревоги и не требовало анксиолитиков. В дальнейшем, до окончания исследования, препарат, назначенный в этой дозе, характеризовался как сбалансированный антидепрессант с мягким седативным эффектом.
Клинически уже в конце первой недели лечения у большинства больных отмечалось улучшение самочувствия. Наряду с быстрым уменьшением выраженности тревоги, наблюдалось улучшение сна. Больные отмечали улучшение качества сна, он становился более глубоким, возвращалось чувство бодрости при пробуждении по утрам. Результаты приведены на рисунке 7.
Быстрое уменьшение выраженности тревоги позволило большинству больных отказаться от приема анксиолитиков, назначенных в период «wash out» или на предыдущих этапах лечения. Объективно пациенты становились контактнее, активнее в беседе, отмечали, что начинает восстанавливаться утраченный в период депрессии интерес к привычному кругу занятий, увлечений. Эти изменения были отражены при анализе краткой шкалы качества жизни ВОЗ (рис. 8).
Эти изменения были отражены при анализе краткой шкалы качества жизни ВОЗ (рис. 8).
Результаты показывают высокую достоверность улучшения по этому показателю (р ≤ 0,01) у пациентов после проведенного курса терапии по сравнению с моментом включения в исследование.
В настоящем исследовании венлафаксин проявил себя как препарат с хорошей переносимостью. В одном случае отмечалось выбытие пациента из исследования в связи с мидриазом. Нежелательное явление было нетяжёлым, но пациентка отказалась от продолжения терапии и корректировки дозы. У 14 (43,3 %) из 29 больных было зарегистрировано 20 случаев НЯ, однако связь их развития с приемом венлафаксина оценивалась как «вероятная» только в 6 случаях, а в остальных случаях как «предполагаемая». Оценка интенсивности НЯ показала, что 12 (60 %) из 20 случаев НЯ были слабой интенсивности, 8 (40 %) – умеренной. В большинстве случаев никаких мер в отношении терапии принято не было, но в 5 из 20 (40 %) случаев доза препарата была уменьшена. Все НЯ, имевшие место в период исследования и встречавшиеся с частотой более чем 1 случай, представлены в таблице.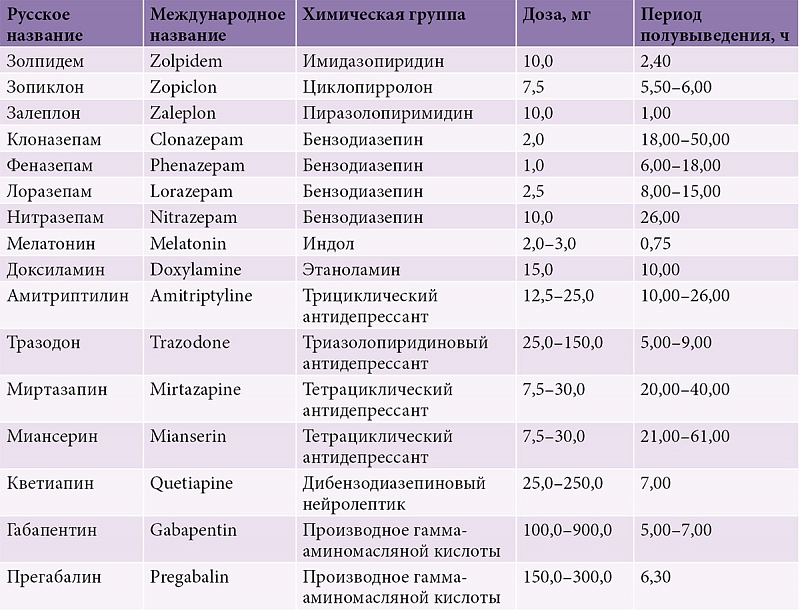
Как видно из таблицы, наибольший удельный вес среди НЯ занимают тошнота и мидриаз. В большинстве случаев они проявлялись в первые две недели терапии. Сонливость, как правило, наблюдалась на 1-й неделе лечения что, возможно, наряду с показателями динамики коэффициента соотношения редукции тревоги и заторможенности, отражает некоторое седативное действие препарата в первые дни терапии. Анализ исходов НЯ показал, что в подавляющем большинстве случаев (80 %) НЯ были преходящими. В большинстве случаев они развивались в первую неделю терапии при применении дозы от 150 мг/сут и, в дальнейшем, по мере продолжения терапии, редуцировались. При дальнейшем увеличении дозы препарата у большинства больных роста частоты НЯ, как правило, не происходило. Кроме того, после первой недели терапии, нежелательные явления отмечались только при использовании доз от 150 мг/сут.
Обсуждение
Подводя итоги исследования, необходимо отметить высокую эффективность венлафаксина, и, что особенно важно, 50 % редукция симптоматики наступала достаточно быстро, на 2-3-й неделе терапии. В литературе есть данные о более раннем клиническом ответе (в пределах 1-й, реже 2-й недели терапии) при применении высоких доз венлафаксина [13, 14, 15]. Однако дизайн этих исследований был построен на быстром наращивании венлафаксина. Наиболее показательно исследование, в котором сравнивались 3 группы больных, принимающих разные дозы венлафаксина (75 мг – первая группа; 150-225 мг – вторая группа; 300-375 мг – третья группа). Результаты этой работы показали, что в 1-й и 2-й группах пациентов начало первичного ответа наблюдали в первые 2 недели терапии, тогда как в 3-й группе больных, принимающих наиболее высокую дозу препарата, статистически достоверный эффект отмечен уже на 1-й неделе лечения [15]. Режим наращивания дозы в настоящем исследовании отличался от описанных выше большей гибкостью, что позволило безопасно и эффективно использовать венлафаксин для терапии депрессивных расстройств у амбулаторных пациентов. Очевидно, что стратегия быстрого наращивания дозы, позволяющая в полной мере использовать дозозависимый эффект венлафаксина, особенно целесообразна при терапии тяжёлых депрессивных расстройств в стационарных условиях.
В литературе есть данные о более раннем клиническом ответе (в пределах 1-й, реже 2-й недели терапии) при применении высоких доз венлафаксина [13, 14, 15]. Однако дизайн этих исследований был построен на быстром наращивании венлафаксина. Наиболее показательно исследование, в котором сравнивались 3 группы больных, принимающих разные дозы венлафаксина (75 мг – первая группа; 150-225 мг – вторая группа; 300-375 мг – третья группа). Результаты этой работы показали, что в 1-й и 2-й группах пациентов начало первичного ответа наблюдали в первые 2 недели терапии, тогда как в 3-й группе больных, принимающих наиболее высокую дозу препарата, статистически достоверный эффект отмечен уже на 1-й неделе лечения [15]. Режим наращивания дозы в настоящем исследовании отличался от описанных выше большей гибкостью, что позволило безопасно и эффективно использовать венлафаксин для терапии депрессивных расстройств у амбулаторных пациентов. Очевидно, что стратегия быстрого наращивания дозы, позволяющая в полной мере использовать дозозависимый эффект венлафаксина, особенно целесообразна при терапии тяжёлых депрессивных расстройств в стационарных условиях.
Дозозависимый эффект венлафаксина, связанный со ступенчатым включением в орбиту влияния препарата различных медиаторных структур (серотонин, норадреналин, дофамин), опосредованно приводит к различию в особенностях клинического действия. Так, в проведенном исследовании препарат, применяемый в больших дозах (более 150 мг/сут) проявил себя как преимущественно седативный, в то время как в меньших дозах обладал более сбалансированным действием.
Препарат отличался достаточно высокой переносимостью. Ни у одного пациента не было зарегистрировано тяжёлых нежелательных явлений, подавляющее число побочных эффектов имело дозозависимый характер и отмечалось, преимущественно, в первые 2 недели терапии.
Учитывая достаточно выраженный седативный эффект препарата на первых неделях терапии и возможность управлять им в зависимости от динамики дозы, а также быструю редукцию нарушений сна и сбалансированный характер действия после 3-х недель терапии, можно отметить, что венлафаксин является одним из оптимальных препаратов выбора для депрессивных больных в амбулаторных условиях.
Таким образом, резюмируя результаты проведенного исследования, можно заключить, что венлафаксин обладает отчетливым тимоаналептическим действием и имеет сбалансированный характер влияния на симптоматику тревоги и заторможенности, с умеренным седативным эффектом в первую неделю терапии. Особенно важной представляется способность препарата достаточно быстро редуцировать депрессивные расстройства любой тяжести, а также широкий круг коморбидных депрессий тревожных нарушений.
Литература.
1. Danish University Antidepressant Group. Citalopram: clinical effect profile in comparison with clomipramine. A controlled multicenter study // Psychopharmacology 1986; 90: 131-138.
2. Danish University Antidepressant Group. Paroxetine: a selective serotonin reuptake inhibitor showing better tolerance, but weaker antidepressant effect than clomipramine in a controlled multicenter study // J Affective Disorders 1990; 18: 289-299.
3. Anderson I.M., Tomenson B.M. The efficacy of selective serotonin re-uptake inhibitors in depression: a meta-analysis of studies against tricyclic antidepressants.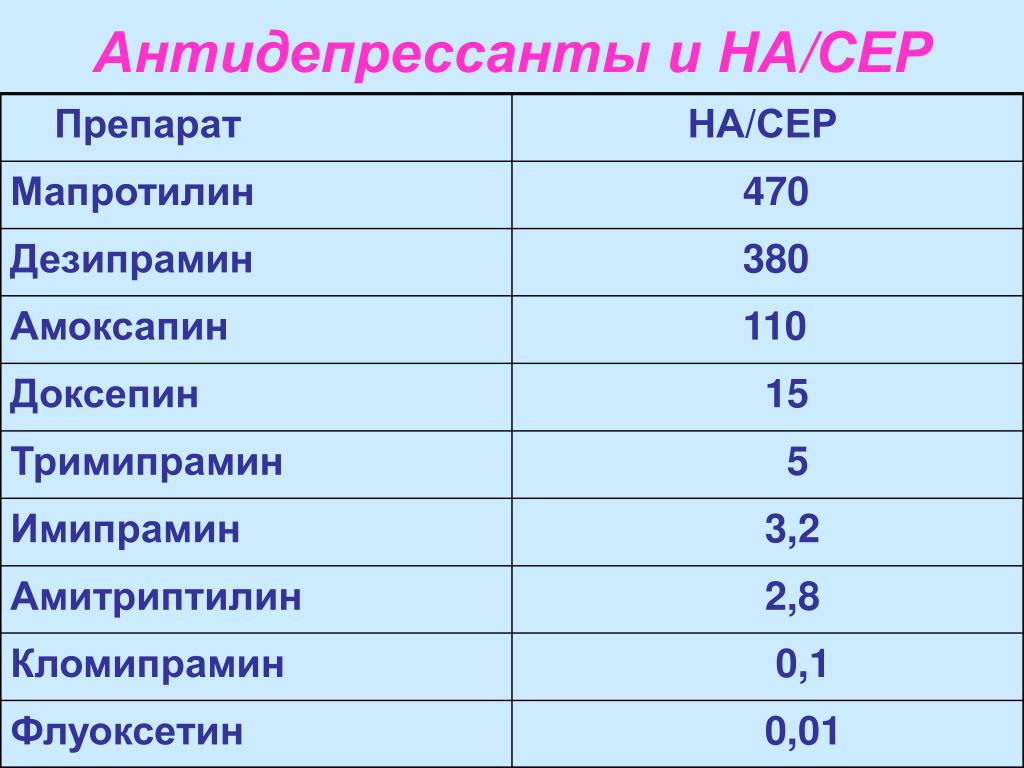 J Psychopharmacol 1994; 8:.238-49.
J Psychopharmacol 1994; 8:.238-49.
4. Anderson I.M. SSRIs versus tricyclic antidepressants in depressed inpatients: a meta-analysis of efficacy and tolerability // Depression Anxiety 1998; 7: Suppl. 1: 11-17.
5. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПБ.: 1995.
6. Смулевич А.Б. Депрессии в общей медицине. М.: 2001.
7. Preskorn S.H. Applied Clinical Psychopharmacology // J Practical Psychiatry and Behavioral Health, 1999, July; 224-8.
8. Samuelian J.C., Hackett D. A randomized, double-blind comparison of venlafaxine and clomipramine in outpatients with major depression // J Psychopharmacol 1998; 12: 3: 273-278.
9. Benedictis E. Double-blind comparison of venlafaxine and amitriptyline in outpatients with or without melancholia // J Psychopharmacol 2000; 14: 1: 61-66.
10. Schweizer E., Feigner J., Mandos et al. Comparison of venlafaxine and imipramine in the acute treatment of major depression in outpatients // J Clin Psychiatry 1994; 55: 3: 104-108.
11. Danjou P, Hackett D. Safety and tolerance profile of venlafaxine // Internat Clin Psychopharmacol 1995; 10: 15-20.
12. Preskorn S.H. Comparison of the tolerability of buproprion, fluoxetine, imipramine, nefazodone, paroxetine, sertraline and venlafaxine // J Clin Psychiat 1995; 56: 1221.
13. Wang C.P., Howell S.R., Scatina J., Sisenwine S.F. The disposition of venlafaxine enanto-mers in dogs, rats, and humans receiving venlafaxine// Chirality 1992; 4: 84-90.
14. Khan A., Fabre L., Rudolph R. Venlafaxine in depressed outpatients // Psychopharmacol Bull 1991; 27: 141-4.
15. Schweizer E., Weise C., Clary C. et al. Placebo controlled trial of venlafaxine for the treatment of major depression // J Clin Psychopharmacol 1991; 11: 233-236.
[PDF] Сравнительная эффективность и переносимость 12 антидепрессантов нового поколения: метаанализ множественного лечения
Сравнительная эффективность и переносимость антиманиакальных препаратов при острой мании: метаанализ множественного лечения
- A.
- 2011
 Cipriani, C. Barbui, J. Geddes
Cipriani, C. Barbui, J. GeddesПсихология, медицина
The Lancet
Сравнительная эффективность и приемлемость антидепрессантов первого и второго поколения при остром лечении большой депрессии: протокол сетевого метаанализа
- T. Furukawa, G. Salanti, A. Cipriani
- 2016
Психология
BMJ Open
Сравнительная эффективность, приемлемость и переносимость аугментационных препаратов при терапевтически резистентной депрессии: систематический обзор и сетевой метаанализ.
- Xinyu Zhou, A. Ravindran, P. Xie
- 2015
Psychology, Medicine
The Journal of Clinical psychiatry

Эффективность и приемлемость фармакологического лечения депрессивных расстройств в первичной медико-санитарной помощи: систематический обзор и сетевой метаанализ
- K. Linde, L. Kriston, A. Schneider
- 2015
Медицина, психология
The Annals of Family Medicine
P-1102 – Сравнительная эффективность антидепрессантов второго поколения при фармакологическом лечении депрессии у взрослых
- L. Morgan, G. Gartlehner, H.A. Ричард
- 2012
Психология, медицина
Европейская психиатрия
Сравнительная эффективность и переносимость антидепрессантов при большом депрессивном расстройстве у детей и подростков: сетевой мета-анализ
- A.
- 2016
 Cipriani, Xinyu Zhou , П. Се
Cipriani, Xinyu Zhou , П. СеПсихология, Медицина
Сравнительная эффективность и приемлемость 21 антидепрессанта для неотложной терапии большого депрессивного расстройства у взрослых: систематический обзор и сетевой метаанализ
- A. Cipriani, T. Furukawa, J. Geddes
- 2018
Психология, медицина
The Lancet
Профиль побочных эффектов и сравнительная переносимость 21 антидепрессанта при остром лечении большой депрессии у взрослых: протокол сетевого метаанализа
- A. Tomlinson, O. Eftimiou, A. Cipriani
- 2019
Психология, медицина
Психическое здоровье, основанное на доказательствах

Приемлемость эсциталопрама по сравнению с дулоксетином у амбулаторных пациентов с депрессией, которые не ответили на начальную терапию антидепрессантами второго поколения: рандомизированное исследование с параллельными группами, не менее эффективное исследование.
- K. Nakagome, Y. Yokoi, Takayuki Abe
- 2021
Психология, медицина
Журнал аффективных расстройств
Эффективность и экономическая эффективность антидепрессантов в первичной медико-санитарной помощи: сравнение нескольких методов лечения Meta-Ana лизис и экономичность Модель
- J. Ramsberg, C. Asseburg, M. Henriksson
- 2012
Медицина, Психология
PloS one

История антидепрессантов — Mid City TMS
История антидепрессантов началась случайно. В 1950-х годах перед химиками была поставлена задача найти лекарство от туберкулеза, и они начали экспериментировать с избыточным ракетным топливом, оставшимся со складов времен Второй мировой войны. Два химических вещества, ипрониазид и изониазид, оказались многообещающими из-за их способности уничтожать бактерии. Хотя лечение в конечном итоге не помогло вылечить пациентов с туберкулезом, исследователи заметили благотворное влияние лекарств на психическое состояние пациентов. Эти соединения повышали уровень моноаминов, нейротрансмиттеров, которые, как известно, влияют на настроение, и, таким образом, стали важными компонентами первых антидепрессантов.
Merriam Webster определяет антидепрессант как «препарат, который используется для облегчения или предотвращения депрессии у человека». Разработка антидепрессантов позволила миллионам людей вернуть свою жизнь из тьмы и найти способы справиться с состояниями, которых невозможно избежать. Эти лекарства являются основными продуктами в жизни многих людей, поэтому трудно представить мир без доступа к такого рода медицинской помощи. Антидепрессанты официально прописывают всего 70 лет, и наука, стоящая за ними, все еще развивается с каждым днем. Чтобы лучше понять состояние психического здоровья сегодня, важно оглянуться назад на историю антидепрессантов и понять, как эти лекарства развивались.
Эти лекарства являются основными продуктами в жизни многих людей, поэтому трудно представить мир без доступа к такого рода медицинской помощи. Антидепрессанты официально прописывают всего 70 лет, и наука, стоящая за ними, все еще развивается с каждым днем. Чтобы лучше понять состояние психического здоровья сегодня, важно оглянуться назад на историю антидепрессантов и понять, как эти лекарства развивались.
История антидепрессантов
Первое поколение
Первым поколением антидепрессантов были трициклические антидепрессанты (ТЦА) и ингибиторы моноаминоксидазы (ИМАО), которые были представлены в 1950-х годах. Хотя эти лекарства стали крупным достижением в области психиатрии, обеспечив, наконец, возможность фармакологического лечения депрессии, они также были проблематичными из-за своих фармакологических свойств и побочных эффектов (Hillhouse & Porter, 2015). Например, трициклические антидепрессанты имеют узкий терапевтический индекс и поэтому могут легко вызвать смертельную токсичность. ТЦА также блокируют эффекты нейротрансмиттера ацетилхолина, что приводит к сухости во рту и глазах, запорам и нерешительности или задержке мочи.
ТЦА также блокируют эффекты нейротрансмиттера ацетилхолина, что приводит к сухости во рту и глазах, запорам и нерешительности или задержке мочи.
ИМАО также могут спровоцировать гипертонический криз в сочетании с пищевым тирамином (который также называют «эффектом сыра») и потреблением вяленого мяса и ферментированных продуктов с одновременным использованием ИМАО (Yamada & Yasuhara, 2004). Хотя эти антидепрессанты первого поколения больше не являются препаратами первого выбора для лечения, они по-прежнему назначаются сегодня и одобрены Всемирной организацией здравоохранения для использования во всем мире.
Второе поколение
Второе поколение антидепрессантов было разработано для более целенаправленного воздействия на определенные нейротрансмиттеры и включает такие классы лекарств, как селективные ингибиторы обратного захвата серотонина (СИОЗС) и ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН). Первым введенным СИОЗС был флуоксетин (прозак) в конце 19 века. 80-е годы.
80-е годы.
Одним из основных преимуществ СИОЗС по сравнению со старыми антидепрессантами было то, что СИОЗС намного безопаснее, в том числе при передозировке. Однако, хотя СИОЗС считаются такими же эффективными, как старые антидепрессанты при легкой или умеренной депрессии, они считались менее эффективными, чем старые антидепрессанты при лечении тяжелой депрессии. Это восприятие привело к разработке других антидепрессантов, таких как СИОЗСН, поскольку акцент сместился с усиления только одного нейротрансмиттера (серотонина) на усиление других нейротрансмиттеров (например, норадреналина и дофамина), участвующих в регуляции настроения.
Первым одобренным SNRI был венлафаксин, также известный под торговой маркой Effexor, в 1993 году для лечения БДР. Форма с немедленным высвобождением (IR), которую принимали два раза в день, была одобрена для MDD в 1993 году. В 1997 году форма пролонгированного высвобождения (XR), которую принимали только один раз в день, также была одобрена для MDD.
Другие показания, которые были добавлены с тех пор, включают генерализованное тревожное расстройство, социальное тревожное расстройство (социальную фобию) и паническое расстройство. Венлафаксин также продемонстрировал эффективность при лечении различных болевых состояний, таких как диабетическая периферическая невропатия и вазомоторные симптомы, связанные с перименопаузой, хотя он не одобрен FDA для такого использования. Дулоксетин, также известный как Симбалта, был одобрен в 2004 году для лечения БДР и стал первым препаратом в США, одобренным для лечения диабетической периферической невропатии. Позже дулоксетин был одобрен для лечения генерализованного тревожного расстройства (ГТР), фибромиалгии и хронической скелетно-мышечной боли. Из-за этого он имеет самые одобренные FDA показания из всех SNRIs (Eli Lilly and Company, 2004).
Десвенлафаксин или Пристик, метаболит венлафаксина, был одобрен в 2008 г. для лечения БДР (Liebowitz et al., 2008). Милнаципран (торговая марка Savella) был одобрен в 2009 году для лечения фибромиалгии в США; однако он не был одобрен в США для лечения БДР, хотя он одобрен для лечения БДР во многих других странах. Левомилнаципран (торговая марка Fetzima), левоэнантиомер милнаципрана, является самым последним дополнением к СИОЗСН и был одобрен в 2013 году для лечения БДР (Wagner et al., 2018).
Левомилнаципран (торговая марка Fetzima), левоэнантиомер милнаципрана, является самым последним дополнением к СИОЗСН и был одобрен в 2013 году для лечения БДР (Wagner et al., 2018).
Второе поколение антидепрессантов в истории сложное, и исследования все еще продолжаются. Хотя многие лекарства второго поколения имеют меньше побочных эффектов, чем их аналоги ТЦА, они обладают блокирующими амины и седативными свойствами, о которых следует помнить. Врачи должны знать о других состояниях пациента, чтобы безопасно назначать лекарства. Например, препарат бупропион считается безопасным вариантом, но иногда может повышать риск судорог, и поэтому его не следует назначать пациенту с этим заболеванием в анамнезе.
Процесс лечения
Человеческий разум — это сложный механизм, который врачи и ученые только начали понимать. Подобно тому, как БДР и другие расстройства проявляются по-разному у каждого человека, так и эффекты антидепрессантов будут проявляться по-разному. Важно сохранять бдительность в отношении ваших симптомов или психического состояния ваших близких, если вводится новый план лечения. Обращайте внимание на изменения настроения, изоляцию или суицидальные мысли и действия, поскольку некоторые лекарства могут усилить эти симптомы. Лекарства не всегда эффективны, и поиск идеального антидепрессанта методом проб и ошибок может привести к эмоциональным потерям, но этот процесс необходим для достижения ремиссии.
Обращайте внимание на изменения настроения, изоляцию или суицидальные мысли и действия, поскольку некоторые лекарства могут усилить эти симптомы. Лекарства не всегда эффективны, и поиск идеального антидепрессанта методом проб и ошибок может привести к эмоциональным потерям, но этот процесс необходим для достижения ремиссии.
Принимаете антидепрессанты и нуждаетесь в дополнительной поддержке? Позвоните в Mid City TMS
. Хотя многие находят облегчение от депрессии только с помощью лекарств, антидепрессанты не всегда эффективны. Некоторые пациенты с БДР не могут добиться улучшения симптомов с помощью одних лекарств, и в этом может помочь ТМС Мид Сити. Mid City TMS — это лечебный центр в Нью-Йорке, специализирующийся на транскраниальной магнитной стимуляции при депрессии и тревоге. ТМС – это неинвазивный метод лечения, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, который использует электромагнитные импульсы для стимуляции областей мозга, пораженных депрессией.
