Когнитивные нарушения при депрессии и перспективы применения антидепрессантов с прокогнитивным эффектом
В последние годы интерес к роли когнитивных нарушений при аффективных расстройствах существенно возрос. Это обусловлено тем, что преобладавшая длительное время нейромедиаторная концепция депрессии в терапевтическом плане во многом себя исчерпала [1, 2]. В результате исследователи обратились к поиску новых теоретических подходов, которые пришли бы на смену прежним моделям лечения расстройств настроения [3]. Одним из них стал когнитивный подход. Надежды на него в большой степени связаны с успехами когнитивной психотерапии, а также исследованиями, направленными на изучение патогенетической роли нарушений социальной перцепции [4-7].
Несмотря на сказанное, в настоящее время не существует однозначного понимания, что такое когнитивные расстройства. Многие отождествляют их с нарушением внимания, памяти и мышления, а методологию когнитивного подхода — с нейропсихологическими и психофизиологическими тестами. Между тем когнитивное направление требует более широкого ракурса для оценки психических расстройств, которые качественно отличаются от проявлений нормальной психической жизни [8]. По существу когнитивный подход проецирует различные психопатологические синдромы и симптомы в единую плоскость анализа — плоскость информационных систем [9]. Так, согласно когнитивному подходу, депрессия — это состояние, при котором происходят специфические нарушения анализа и синтеза информации. Информация не только селективно отбирается, но и обрабатывается односторонне и неполно. Эти нарушения описываются в терминах ошибок суждения (например, дихотомическое мышление или сверхгенерализация), «автоматических» мыслей, базисных убеждений и когнитивных схем [6, 10]. Кроме того, при депрессии обнаруживается так называемый «депрессивный сдвиг», который затрагивает сферу внимания, мышления, памяти и прогнозирования [11]. В основе указанных проявлений депрессии лежат нарушения механизмов оценки информации, которые приводят к тому, что у больных начинают преобладать негативные, пессимистические и тормозные установки.
Между тем когнитивное направление требует более широкого ракурса для оценки психических расстройств, которые качественно отличаются от проявлений нормальной психической жизни [8]. По существу когнитивный подход проецирует различные психопатологические синдромы и симптомы в единую плоскость анализа — плоскость информационных систем [9]. Так, согласно когнитивному подходу, депрессия — это состояние, при котором происходят специфические нарушения анализа и синтеза информации. Информация не только селективно отбирается, но и обрабатывается односторонне и неполно. Эти нарушения описываются в терминах ошибок суждения (например, дихотомическое мышление или сверхгенерализация), «автоматических» мыслей, базисных убеждений и когнитивных схем [6, 10]. Кроме того, при депрессии обнаруживается так называемый «депрессивный сдвиг», который затрагивает сферу внимания, мышления, памяти и прогнозирования [11]. В основе указанных проявлений депрессии лежат нарушения механизмов оценки информации, которые приводят к тому, что у больных начинают преобладать негативные, пессимистические и тормозные установки.
Пациенты с депрессией склонны чрезмерно реагировать на свои ошибки. В исследовании R. Cohen и соавт. [12] было показано, что такие больные совершали больше ошибок в тестах на внимание, чем здоровые добровольцы. При этом пациенты с депрессией не только получали более низкие результаты, но и острее реагировали на них. Ошибки, даже в простом задании на внимание, по-видимому, усиливали у них ощущение неудачи, что находило отражение в идеях несостоятельности. С нарушениями способности к сбалансированной оценке реальности, по всей видимости, связан еще один ключевой для депрессии механизм — руминации, т.е. склонность постоянно возвращаться к негативным мыслям, представлениям и образам [13, 14]. Этот механизм формирует депрессивные установки, а также блокирует способность пациентов решать актуальные жизненные задачи. Когнитивные нарушения приводят к общему снижению эффективности деятельности, замедлению ассоциативного процесса и нарастанию инерционности оценок [15]. Важнейшим проявлением когнитивных расстройств у больных депрессией является нарушение так называемых исполнительных функций, связанных с деятельностью префронтальной коры и обеспечивающих гибкое решение задач, отслеживание результатов деятельности, а также адаптивное изменение поведения [16-18].
Нарушения когнитивных процессов при большой депрессии оказываются сопоставимыми с проявлениями последствий травмы мозга средней степени, когда страдают целенаправленность и последовательность действий, а аффективные процессы становятся неподконтрольными волевым усилиям субъекта [19]. При депрессии отмечается также изменение остроты интерорецепции в форме соматосенсорной амплификации. Это связывается с формированием патологической когнитивной схемы и дисбалансом системы внутренних убеждений [20, 21]. Более того, преобладание в клинической картине депрессии выраженной соматоформной и вегетативной симптоматики может рассматриваться как индикатор нейрокогнитивных нарушений в правом полушарии мозга [22].
Особое значение при депрессии имеют нарушения мнестических процессов [17, 23]. Многие пациенты с депрессией отмечают снижение памяти, которое обусловлено не столько аффективными расстройствами, сколько общим дисфункциональным состоянием психики. Тем не менее имеются и специфичные для депрессии мнестические расстройства, которые обнаруживаются в пробах на свободное воспроизведение и контролируемое распознавание.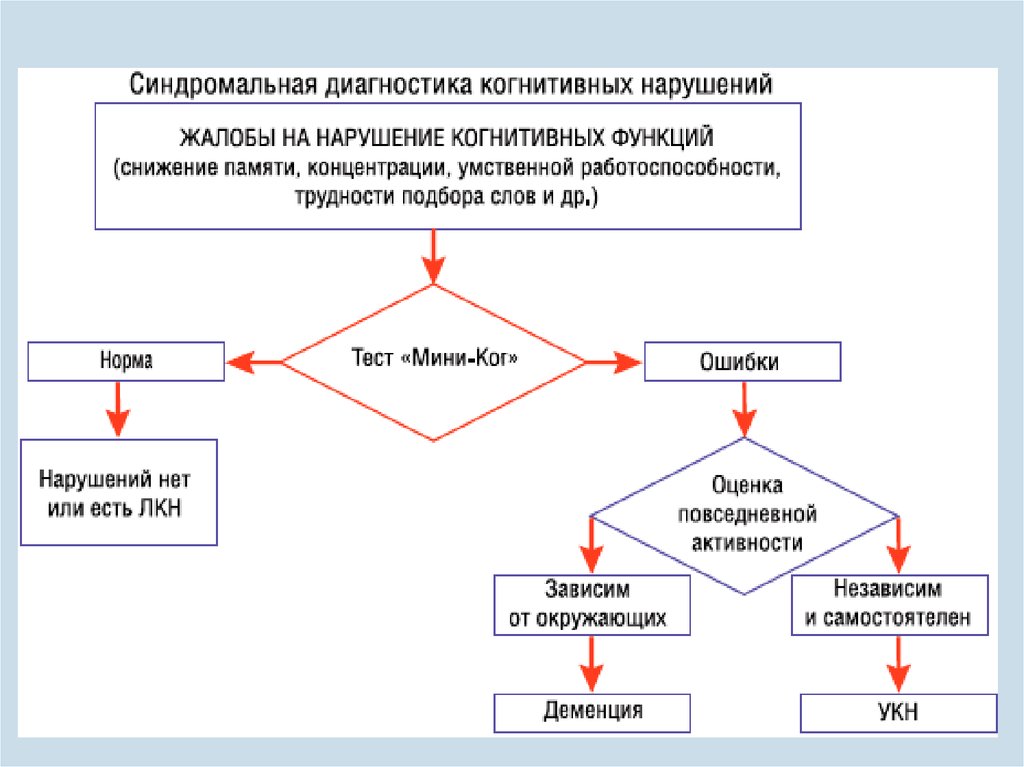

Спорным является вопрос о частоте когнитивных нарушений при депрессии. Различные исследователи выявляют их с неодинаковой частотой [18]. Так в работе M. Grant и соавт. [26] в группе страдающих большой депрессией пациентов различного возраста никаких существенных нейрокогнитивных нарушений зарегистрировано не было. В исследованиях же других авторов [17, 25, 27] подчеркивается полиморфизм и вариабельность нейрокогнитивных нарушений, а также неоднозначность их связи с клиническими особенностями депрессии.
По нашим данным [16], нарушения исполнительных функций, оцениваемые у больных первичного звена здравоохранения при помощи батареи тестов лобной дисфункции, связаны с тяжестью депрессии, однако не коррелируют с выраженностью тревоги. При этом было установлено [28], что когнитивные нарушения не соответствуют нозографической квалификации депрессивных состояний, но в то же время ассоциируются с паттерном поведения, характерным для меланхолической депрессии.
Сопутствующие когнитивные дисфункции, по крайней мере в ряде случаев, могут являться индикаторами плохого прогноза депрессии [17, 23, 29]. Это особенно характерно для так называемых поздних депрессий [30, 31]. Кроме того, когнитивные нарушения, предшествовавшие депрессивному эпизоду и сохраняющиеся в ремиссии, являются предикторами рецидива и малой эффективности терапии антидепрессантами [32, 33].
Это особенно характерно для так называемых поздних депрессий [30, 31]. Кроме того, когнитивные нарушения, предшествовавшие депрессивному эпизоду и сохраняющиеся в ремиссии, являются предикторами рецидива и малой эффективности терапии антидепрессантами [32, 33].
Сказанное выше подтверждает, что в настоящее время важной практической задачей является разработка методов, позволяющих быстро и надежно выявлять когнитивные нарушения при депрессии.
Определенным подспорьем для клинициста в этом отношении могут стать стандартные вопросы, сформулированные S. Fehnel и соавт. [29]. Они сводятся к следующему: «Вы в состоянии работать так же эффективно, как обычно?»; «Чаще ли, чем обычно, Вы забываете разные вещи?»; «Стало ли для Вас тяжелее принимать решение, что приобрести, когда Вы делаете в магазине покупки?». Ответы на них могут оказаться полезными для выявления когнитивных нарушений при депрессии. Однако отсутствие количественных методик оценки делает невозможным фиксировать их изменения в динамике [34].
На сегодняшний день терапия депрессивного эпизода включает психотерапию, антидепрессанты и изменение образа жизни (например, увеличение физической нагрузки, улучшение сна) [35]. При этом в качестве первого этапа лечения обычно применяются препараты из группы селективных ингибиторов серотонина (СИОЗС). Однако эффективность психофармакологического лечения относительно невелика [36]. Однократный курс применения антидепрессантов только у 54% больных приводит к 50% снижению симптоматики, тогда как при терапии плацебо этот показатель достигает 37%. При проведении натуралистических исследований с последовательным применением различных препаратов ремиссии составляют от 50 до 65%. Присоединение психотерапии заметно повышает общую результативность лечения, однако кардинальных сдвигов не обеспечивает [37].
 Аналогичными эффектами могут обладать и антидепрессанты из группы ингибиторов обратного захвата норадреналина и серотонина (ИОЗНС). Однако восстановление когнитивных функций у таких больных в процессе фармакотерапии не достигает уровня, характеризующего здоровых лиц [41].
Аналогичными эффектами могут обладать и антидепрессанты из группы ингибиторов обратного захвата норадреналина и серотонина (ИОЗНС). Однако восстановление когнитивных функций у таких больных в процессе фармакотерапии не достигает уровня, характеризующего здоровых лиц [41].Одним из возможных методов повышения эффективности лекарственного лечения является применение антидепрессантов в периоде ремиссии, что способствует дальнейшему улучшению памяти и других когнитивных функций [42].
Прокогнитивные эффекты СИОЗС объясняются тем, что серотониновая система выполняет важную роль в процессах научения и памяти. Это обусловлено тем, что указанная система взаимодействует с холинеригическими, глутаматергическими, дофаминергическими и ГАМКергическими системами мозга. Имеется целый ряд указаний на то, что введение агонистов некоторых подтипов серотониновых рецепторов (5-HT2A/2C или 5-HT4) может служить профилактикой нарушения памяти и активизирует процессы научения в побуждающих ситуациях. Но в то же время антагонисты этих рецепторов, а также антагонисты рецепторов 5-HT1A, 5-HT3 и 5-HT1B могут оказывать противоположный эффект [43].
Но в то же время антагонисты этих рецепторов, а также антагонисты рецепторов 5-HT1A, 5-HT3 и 5-HT1B могут оказывать противоположный эффект [43].
Недавно были опубликованы результаты клинической апробации нового антидепрессивного препарата вортиоксетина, который, являясь представителем группы СИОЗС, относится к категории «мультимодальных» антидепрессантов [44]. Это означает, что он оказывает избирательный эффект на некоторые подтипы рецепторов серотониновой системы. В частности, вортеоксетин является агонистом 5-HT1A-рецепторов, частичным агонистом 5-HT1B-рецепторов и антагонистом 5-HT1D-, 5-HT3- и 5-HT7-рецепторов [45, 46].
Доклинические исследования показали, что вортеоксетин может увеличивать уровень серотонина, норадреналина и дофамина в префронтальной коре головного мозга, а также в гиппокампе крыс. Кроме того, это препарат может повышать уровень ацетилхолина и гистамина, что соотносится с прокогнитивным эффектом [46].
В ходе рандомизированного двойного слепого исследования эффективности применения вортиоксетина, дулоксетина и плацебо [47] у пациентов позднего возраста было обнаружено, что как дулоксетин, так и вортиоксетин статистически достоверно улучшали выполнение теста на вербальное научение (Rey Auditory Verbal Learning Test) в сравнении с плацебо. Однако только вортиоксетин улучшал выполнение теста на замену цифр символами (Digit Symbol Substitution Test). Это свидетельствует о том, что данный препарат положительно воздействует на скорость переработки информации, исполнительные функции и внимание. Во втором рандомизированном двойном слепом исследовании [47], выполненном на 598 пациентах разного возраста, страдавших рекуррентной депрессией, данные, свидетельствующие о благоприятном эффекте вортиоксетина на когнитивные функции, были подтверждены. Результаты когнитивного тестирования пациентов, получавших вортиоксетин, по большинству когнитивных проб статистически достоверно превышали плацебо. При этом регистрировался достоверный положительный эффект, который субъективно отмечался пациентами как в отношении когнитивных функций, так и депрессивной симптоматики.
Однако только вортиоксетин улучшал выполнение теста на замену цифр символами (Digit Symbol Substitution Test). Это свидетельствует о том, что данный препарат положительно воздействует на скорость переработки информации, исполнительные функции и внимание. Во втором рандомизированном двойном слепом исследовании [47], выполненном на 598 пациентах разного возраста, страдавших рекуррентной депрессией, данные, свидетельствующие о благоприятном эффекте вортиоксетина на когнитивные функции, были подтверждены. Результаты когнитивного тестирования пациентов, получавших вортиоксетин, по большинству когнитивных проб статистически достоверно превышали плацебо. При этом регистрировался достоверный положительный эффект, который субъективно отмечался пациентами как в отношении когнитивных функций, так и депрессивной симптоматики.
Интерес вызывает также применение с целью купирования когнитивных нарушений при депрессии другого препарата из группы СИОЗС — флувоксамина. Прокогнитивные эффекты флувоксамина связываются с его влиянием на сигма-1-рецепторы [48]. Эти рецепторы, расположенные на мембранах эндоплазматического ретикулума нейронов, выполняют целый ряд регуляторных функций [49]. Важнейшие из них связаны с восстановлением пространственной конфигурации белковых макромолекул, модуляцией функциональной активности многих ионных и метаботропных рецепторов. Сигма-1-рецепторы активизируют также вторичные мессенджеры (протеинкиназы и нейротрофические факторы), передающие сигнал от мембраны нейрона к ядру и митохондриям и улучшающие взаимодействие клеточных органелл. Они также участвуют в ликвидации последствий оксидативного шока и обеспечивают нейропластичность [50].
Эти рецепторы, расположенные на мембранах эндоплазматического ретикулума нейронов, выполняют целый ряд регуляторных функций [49]. Важнейшие из них связаны с восстановлением пространственной конфигурации белковых макромолекул, модуляцией функциональной активности многих ионных и метаботропных рецепторов. Сигма-1-рецепторы активизируют также вторичные мессенджеры (протеинкиназы и нейротрофические факторы), передающие сигнал от мембраны нейрона к ядру и митохондриям и улучшающие взаимодействие клеточных органелл. Они также участвуют в ликвидации последствий оксидативного шока и обеспечивают нейропластичность [50].
Надо сказать, что функциональное значение сигма-1-рецепторов остается во многом недостаточно изученным. В то же время центральное положение этих рецепторов в регуляции функциональной активности нейронов не вызывает сомнения [51].
В различных экспериментах обнаруживается, что активизация таких рецепторов может оказывать влияние на сознание, приводить к улучшению памяти и других когнитивных функций [52, 53].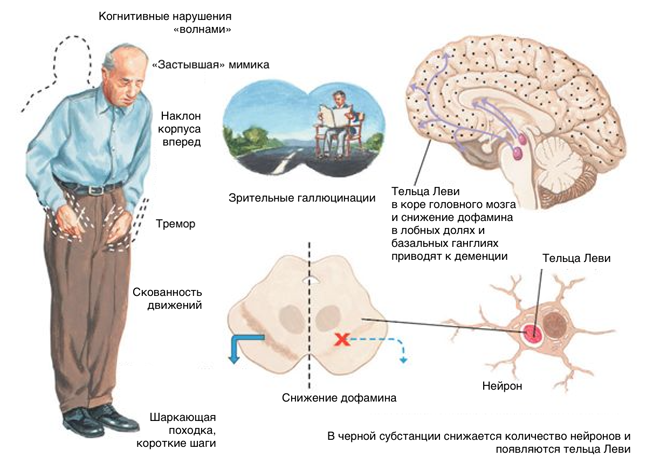 Они могут играть немаловажную роль при лечении депрессии и патологической тревоги, подавлении тяги к наркотикам [54]. Изучение сигма-1-рецепторов может оказаться полезным при разработке новых анальгезирующих средств, а также средств, подавляющих тремор и дистонию [55, 56]. Особое положение флувоксамина обусловлено тем, что этот препарат является самым мощным из известных агонистов сигма-1-рецепторов, и при этом он связывается с указанными рецепторами при приеме в терапевтических дозах [57]. Агонисты сигма-1-рецепторов показали выраженный антиамнестический и нейропротективный эффект на значительном количестве экспериментальных моделей. Среди них — фармакологическая блокада холинергических и NMDA-рецепторов, избирательное пересечение холинергических нейронов, введение бета-амилоидных пептидов, обусловленная возрастом потеря памяти, а также токсическая нейродегенерация и пренатальный стресс [58]. Перспективность изучения флувоксамина как препарата, обладающего потенциально значительным метаботропным и прокогнитивным эффектом, подтверждается также рядом клинических наблюдений [59, 60][1].
Они могут играть немаловажную роль при лечении депрессии и патологической тревоги, подавлении тяги к наркотикам [54]. Изучение сигма-1-рецепторов может оказаться полезным при разработке новых анальгезирующих средств, а также средств, подавляющих тремор и дистонию [55, 56]. Особое положение флувоксамина обусловлено тем, что этот препарат является самым мощным из известных агонистов сигма-1-рецепторов, и при этом он связывается с указанными рецепторами при приеме в терапевтических дозах [57]. Агонисты сигма-1-рецепторов показали выраженный антиамнестический и нейропротективный эффект на значительном количестве экспериментальных моделей. Среди них — фармакологическая блокада холинергических и NMDA-рецепторов, избирательное пересечение холинергических нейронов, введение бета-амилоидных пептидов, обусловленная возрастом потеря памяти, а также токсическая нейродегенерация и пренатальный стресс [58]. Перспективность изучения флувоксамина как препарата, обладающего потенциально значительным метаботропным и прокогнитивным эффектом, подтверждается также рядом клинических наблюдений [59, 60][1].
[1] С учетом сказанного нами был разработан план исследования прокогнитивных свойств флувоксамина и начато его клиническое изучение. Речь идет о научной программе по оценке прокогнитивных эффектов флувоксамина в группе больных с рекуррентной депрессией, находящихся в состоянии неполной терапевтической ремиссии. Она проводится в ФГБУ «Московский научно-исследовательский институт психиатрии» по гранту, предоставленному компанией «Эбботт Лэбораториз».
Пульсовое артериальное давление и когнитивные нарушения | Остроумова
1. Fisher TJ, Schwartz AC, Greenspan HN, et al. Dementia: A complex disease with multiple etiologies and multiple treatments. Int J Psychiatry Med. 2016;51(2):171-81. doi:10.1177/0091217416636579.
2. Silva RMFLD, Miranda CM, Liu T, et al. Atrial Fibrillation and Risk of Dementia: Epidemiology, Mechanisms, and Effect of Anticoagulation. Front Neurosci. 2019;13:18. doi:10.3389/fnins.2019.00018.
3. Iadecola C, Yaffe K, Biller J, et al. ; American Heart Association Council on Hypertension; Council on Clinical Cardiology; Council on Cardiovascular Disease in the Young; Council on Cardiovascular and Stroke Nursing; Council on Quality of Care and Outcomes Research; and Stroke Council. Impact of Hypertension on Cognitive Function: A Scientific Statement From the American Heart Association. Hypertension. 2016;68(6):e67-e94. doi:10.1161/HYP.0000000000000053.
; American Heart Association Council on Hypertension; Council on Clinical Cardiology; Council on Cardiovascular Disease in the Young; Council on Cardiovascular and Stroke Nursing; Council on Quality of Care and Outcomes Research; and Stroke Council. Impact of Hypertension on Cognitive Function: A Scientific Statement From the American Heart Association. Hypertension. 2016;68(6):e67-e94. doi:10.1161/HYP.0000000000000053.
4. Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-104. doi:10.1093/eurheartj/ehy339.
5. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
6. Elias MF, Wolf PA, D’Agostino RB, et al. Untreated blood pressure level is inversely related to cognitive functioning: the Framingham Study. Am J Epidemiol. 1993;138(6):353-64. doi:10.1093/oxfordjournals.aje.a116868.
doi:10.1093/oxfordjournals.aje.a116868.
7. Launer LJ, Masaki K, Petrovitch H, et al. The association between midlife blood pressure levels and late-life cognitive function. The Honolulu-Asia Aging Study. JAMA. 1995;274(23):1846-51. doi:10.1001/jama.1995.03530230032026.
8. Vicario А, Coca А, Gasecki D, et al.; on behalf of the ESH WG on Hypertension and Brain. Effects of antihypertensive treatment on cognitive decline. Scientific Newsletter. Update on Hypertension Management. 2019;20(73). https://www.eshonline.org/esh-content/uploads/2020/01/Newsletter-ESH-73_antihypertensive-treatment_rev3_OK.pdf.
9. Levin RA, Carnegie MH, Celermajer DS. Pulse Pressure: An Emerging Therapeutic Target for Dementia. Front Neurosci. 2020;14:669. doi:10.3389/fnins.2020.00669.
10. Pinto E. Blood pressure and ageing. Postgrad Med J. 2007;83(976):109-14. doi:10.1136/pgmj.2006.048371.
11. Safar ME. Pulse pressure, arterial stiffness and wave reflections (augmentation index) as cardiovascular risk factors in hypertension. Ther Adv Cardiovasc Dis. 2008;2(1):13-24. doi:10.1177/1753944707086652.
Ther Adv Cardiovasc Dis. 2008;2(1):13-24. doi:10.1177/1753944707086652.
12. Lee RM. Morphology of cerebral arteries. Pharmacol Ther. 1995;66(1):149-73. doi:10.1016/0163-7258(94)00071-a.
13. Ballabh P, Braun A, Nedergaard M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol Dis. 2004;16(1):1-13. doi:10.1016/j.nbd.2003.12.016.
14. Armulik A, Genove G, Mae M, et al. Pericytes regulate the blood-brain barrier. Nature. 2010;468(7323):557-61. doi:10.1038/nature09522.
15. Stone J, Johnstone DM, Mitrofanis J, et al. The mechanical cause of age-related dementia (Alzheimer’s disease): the brain is destroyed by the pulse. J Alzheimers Dis. 2015;44(2):355-73. doi:10.3233/JAD-141884.
16. Thorin-Trescases N, de Montgolfier O, Pincon A, et al. Impact of pulse pressure on cerebrovascular events leading to age-related cognitive decline. Am J Physiol Heart Circ Physiol. 2018;314(6):h2214-h2224. doi:10.1152/ajpheart.00637.2017.
17. Tarumi T, Ayaz Khan M, Liu J, et al. Cerebral hemodynamics in normal aging: central artery stiffness, wave reflection, and pressure pulsatility [published correction appears in J Cereb Blood Flow Metab. 2014 Jul;34(7):1255. Tseng, Benjamin M [corrected to Tseng, Benjamin Y]]. J Cereb Blood Flow Metab. 2014;34(6):971-8. doi:10.1038/jcbfm.2014.44.
18. Waldstein SR, Rice SC, Thayer JF, et al. Pulse pressure and pulse wave velocity are related to cognitive decline in the Baltimore Longitudinal Study of Aging. Hypertension. 2008;51(1):99-104. doi:10.1161/HYPERTENSIONAHA.107.093674.
19. Mitchell GF, van Buchem MA, Sigurdsson S, et al. Arterial stiffness, pressure and flow pulsatility and brain structure and function: the Age, Gene/Environment Susceptibility — Reykjavik study. Brain. 2011;134(Pt 11):3398-407. doi:10.1093/brain/awr253.
20. Meyer ML, Palta P, Tanaka H, et al. Association of Central Arterial Stiffness and Pressure Pulsatility with Mild Cognitive Impairment and Dementia: The Atherosclerosis Risk in Communities Study-Neurocognitive Study (ARIC-NCS).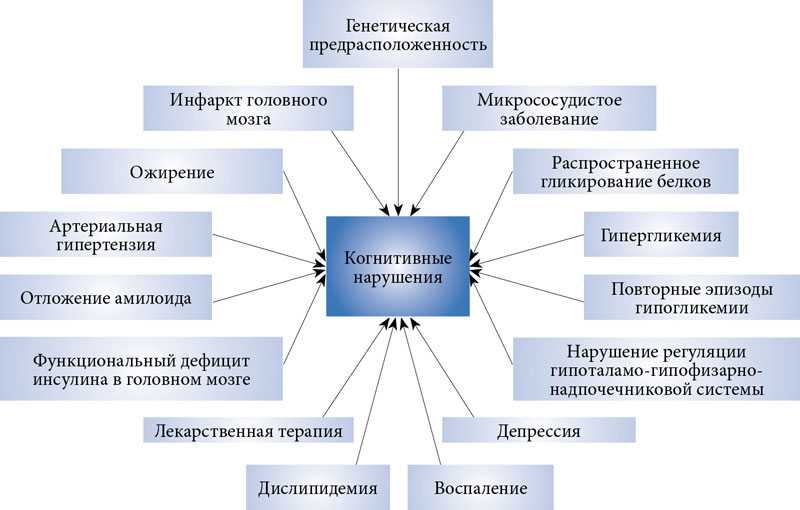 J Alzheimers Dis. 2017;57(1):195-204. doi:10.3233/JAD-161041.
J Alzheimers Dis. 2017;57(1):195-204. doi:10.3233/JAD-161041.
21. Chiesa ST, Masi S, Shipley MJ, et al. Carotid artery wave intensity in mid- to late-life predicts cognitive decline: the Whitehall II study. Eur Heart J. 2019;40(28):2300-9. doi:10.1093/eurheartj/ehz189.
22. de Montgolfier O, Pincon A, Pouliot P, et al. High Systolic Blood Pressure Induces Cerebral Microvascular Endothelial Dysfunction, Neurovascular Unit Damage, and Cognitive Decline in Mice. Hypertension. 2019;73(1):217-28. doi:10.1161/HYPERTENSIONAHA.118.12048.
23. Gao J, Huang T, Zhou LJ, et al. Preconditioning effects of physiological cyclic stretch on pathologically mechanical stretch-induced alveolar epithelial cell apoptosis and barrier dysfunction. Biochem Biophys Res Commun. 2014;448(3):342-8. doi:10.1016/j.bbrc.2014.03.063.
24. Jufri NF, Mohamedali A, Avolio A, et al. Mechanical stretch: physiological and pathological implications for human vascular endothelial cells. Vasc Cell. 2015;7:8. doi:10.1186/s13221-015-0033-z.
doi:10.1186/s13221-015-0033-z.
25. Swardfager W, Lanctot K, Rothenburg L, et al. A meta-analysis of cytokines in Alzheimer’s disease. Biol Psychiatry. 2010;68(10):930-41. doi:10.1016/j.biopsych.2010.06.012.
26. Ju Hwang C, Choi DY, Park MH, et al. NF-kB as a Key Mediator of Brain Inflammation in Alzheimer’s Disease. CNS Neurol Disord Drug Targets. 2019;18(1):3-10. doi:10.2174/1871527316666170807130011.
27. Gangoda SVS, Avadhanam B, Jufri NF, et al. Pulsatile stretch as a novel modulator of amyloid precursor protein processing and associated inflammatory markers in human cerebral endothelial cells. Sci Rep. 2018;8(1):1689. doi:10.1038/s41598-018-20117-6.
28. Wang BW, Chang H, Lin S, et al. Induction of matrix metalloproteinases-14 and -2 by cyclical mechanical stretch is mediated by tumor necrosis factor-alpha in cultured human umbilical vein endothelial cells. Cardiovasc Res. 2003;59(2):460-9. doi:10.1016/s0008-6363(03)00428-0.
29. Jufri NF, Mohamedali A, Ahn SB, et al. Effects of acute and chronic biomechanical strain on human cerebral endothelial cells in altering their proteome profile. Current Proteomics. 2017;14(3):214-23. doi:10.2174/1570164614666170213141932.
Effects of acute and chronic biomechanical strain on human cerebral endothelial cells in altering their proteome profile. Current Proteomics. 2017;14(3):214-23. doi:10.2174/1570164614666170213141932.
30. Haft CR, de la Luz Sierra M, Barr VA, et al. Identification of a family of sorting nexin molecules and characterization of their association with receptors. Mol Cell Biol. 1998;18(12):7278-87. doi:10.1128/mcb.18.12.7278.
31. Zhao Y, Wang Y, Yang J, et al. Sorting nexin 12 interacts with BACE1 and regulates BACE1-mediated APP processing. Mol Neurodegener. 2012;7:30. doi:10.1186/1750-1326-7-30.
32. Adachi H, Tsujimoto M. FEEL-1, a novel scavenger receptor with in vitro bacteria-binding and angiogenesis-modulating activities. J Biol Chem. 2002;277(37):34264-70. doi:10.1074/jbc.M204277200.
33. Miranda S, Opazo C, Larrondo LF, et al. The role of oxidative stress in the toxicity induced by amyloid beta-peptide in Alzheimer’s disease. Prog Neurobiol. 2000;62(6):633-48. doi:10.1016/s0301-0082(00)00015-0.
doi:10.1016/s0301-0082(00)00015-0.
34. Sagare AP, Bell RD, Zhao Z, et al. Pericyte loss influences Alzheimer-like neurodegeneration in mice. Nat Commun. 2013;4:2932. doi:10.1038/ncomms3932.
35. Robinson SR, Dang TN, Dringen R, et al. Hemin toxicity: a preventable source of brain damage following hemorrhagic stroke. Redox Rep. 2009;14(6):228-35. doi:10.1179/135100009X12525712409931.
36. Cullen KM, Kocsi Z, Stone J. Microvascular pathology in the aging human brain: evidence that senile plaques are sites of microhaemorrhages. Neurobiol Aging. 2006;27(12):1786-96. doi:10.1016/j.neurobiolaging.2005.10.016.
37. Cortes-Canteli M, Zamolodchikov D, Ahn HJ, et al. Fibrinogen and altered hemostasis in Alzheimer’s disease. J Alzheimers Dis. 2012;32(3):599-608. doi:10.3233/JAD-2012-120820.
38. van Sloten TT, Stehouwer CD. Carotid Stiffness: A Novel Cerebrovascular Disease Risk Factor. Pulse (Basel) 2016;4(1):24-7. doi:10.1159/000445354.
39. Mitchell GF. Effects of central arterial aging on the structure and function of the peripheral vasculature: implications for end-organ damage. J Appl Physiol 2008;105:1652-60. doi:10.1152/japplphysiol.90549.2008.
J Appl Physiol 2008;105:1652-60. doi:10.1152/japplphysiol.90549.2008.
40. Rothwell PM. Limitations of the usual blood-pressure hypothesis and importance of variability, instability, and episodic hypertension. Lancet. 2010;375(9718):938-48. doi:10.1016/S0140-6736(10)60309-1.
41. Lee AT, Chan WC, Chiu HF, et al. Widened pulse pressure is a potential risk factor for significant cognitive impairment among community-dwelling Chinese younger old people. J Alzheimers Dis. 2013;35(4):687-96. doi:10.3233/JAD-122116.
42. Yasar S, Ko JY, Nothelle S, et al. Evaluation of the effect of systolic blood pressure and pulse pressure on cognitive function: the Women’s Health and Aging Study II. PLoS One. 2011;6(12):e27976. doi:10.1371/journal.pone.0027976.
43. Giordano N, Tikhonoff V, Palatini P, et al. Cognitive functions and cognitive reserve in relation to blood pressure components in a population-based cohort aged 53 to 94 years. Int J Hypertens. 2012;2012:274851. doi:10.1155/2012/274851.
44. McDade E, Sun Z, Lee CW, et al. The association between pulse pressure change and cognition in late life: Age and where you start matters. Alzheimers Dement (Amst). 2016;4:56-66. doi:10.1016/j.dadm.2016.03.008.
45. Riba-Llena I, Nafria C, Filomena J, et al. High daytime and nighttime ambulatory pulse pressure predict poor cognitive function and mild cognitive impairment in hypertensive individuals. J Cereb Blood Flow Metab. 2016;36(1):253-63. doi:10.1038/jcbfm.2015.90.
46. Riba I, Jarca CI, Mundet X, et al. Cognitive assessment protocol design in the ISSYS (Investigating Silent Strokes in hYpertensives: a magnetic resonance imaging Study). J Neurol Sci. 2012;322(1-2):79-81. doi:10.1016/j.jns.2012.06.015.
47. Кобалава Ж. Д., Толкачева В. В., Багманова Н. Х. и др. Эффективность и переносимость Арифама у пациентов с артериальной гипертонией старше 55 лет: основные результаты наблюдательной программы АРБАЛЕТ. Российский кардиологический журнал. 2018;(12):64-74. doi:10. 15829/1560-4071-2018-12-64-74.
15829/1560-4071-2018-12-64-74.
48. Зуева И. Б., Ванаева К. И., Санец Е. Л. и др. Влияние антигипертензивной терапии на когнитивные расстройства у пациентов с артериальной гипертензией и ожирением. Артериальная гипертензия. 2012;18(4):325-33. doi:10.18705/1607-419X-2012-18-4-325-333.
49. Илов Н. Н., Шварц Р. Н., Панова Т. Н. Когнитивно-мнестические функции у больных гипертонической болезнью трудоспособного возраста при лечении амлодипином. Рациональная Фармакотерапия в Кардиологии. 2011;7(3):313-8. doi:10.20996/1819-6446-2011-7-3-313-318.
50. Thibault O, Landfield PW. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 1996;272(5264):1017-20. doi:10.1126/science.272.5264.1017.
51. Thibault O, Gant JC, Landfield PW. Expansion of the calcium hypothesis of brain aging and Alzheimer’s disease: minding the store. Aging Cell. 2007;6(3):307-17. doi:10.1111/j.1474-9726.2007.00295.x.
52. Berridge MJ. Calcium signalling and Alzheimer’s disease. Neurochem Res. 2011;36(7):1149-56. doi:10.1007/s11064-010-0371-4
Neurochem Res. 2011;36(7):1149-56. doi:10.1007/s11064-010-0371-4
53. Lu M, Ma L, Wang X. Indapamide suppresses amyloid-в production in cellular models of alzheimer’s disease through regulating BACE1 activity. Int J Clin Exp Med. 2017;10(4):5922-30.
54. Chillon JM, Baumbach GL. Effects of indapamide, a thiazide-like diuretic, on structure of cerebral arterioles in hypertensive rats. Hypertension. 2004;43(5):1092-7. doi:10.1161/01.HYP.0000122874.21730.81.
55. Nishioku T, Takata F, Yamauchi A, et al. Protective action of indapamide, a thiazide-like diuretic, on ischemia-induced injury and barrier dysfunction in mouse brain microvascular endothelial cells. J Pharmacol Sci. 2007;103(3):323-7. doi:10.1254/jphs.sc0060222.
56. Chiu WC, Ho WC, Lin MH, et al. Angiotension receptor blockers reduce the risk of dementia. J Hypertens. 2014;32(4):938-47. doi:10.1097/HJH.0000000000000086.
Легкие когнитивные нарушения — UCI MIND
Переход от нормального старения к болезни Альцгеймера незаметен, симптомы проявляются постепенно. Каждый может ожидать когнитивных изменений с возрастом. Общие изменения, связанные с нормальным старением, включают более медленное запоминание информации, такой как имена, повышенные усилия для изучения и хранения новой информации, большую восприимчивость к отвлечению внимания, более медленную обработку новой информации и большие трудности при многозадачности.
Каждый может ожидать когнитивных изменений с возрастом. Общие изменения, связанные с нормальным старением, включают более медленное запоминание информации, такой как имена, повышенные усилия для изучения и хранения новой информации, большую восприимчивость к отвлечению внимания, более медленную обработку новой информации и большие трудности при многозадачности.
Ученые и врачи описывают три стадии развития и прогрессирования болезни Альцгеймера:
- Доклиническая или досимптоматическая фаза: заметные симптомы.
- Легкое когнитивное нарушение (MCI): Симптомы становятся заметными для пострадавшего человека и/или семьи, и нарушение является значительным, но не мешает повседневной деятельности.
- Деменция: Происходит значительная потеря интеллектуальных способностей, влияющая на память плюс одну или несколько других когнитивных способностей, и нарушение мешает повседневной деятельности.

Прогрессирование от нормального старения к болезни Альцгеймера или другому виду деменции
Установленный фактор риска болезни Альцгеймера, ЛКН — это состояние, при котором человеку заметны проблемы с памятью и/или другими когнитивными функциями (например, речь, зрительно-пространственные навыки). затронуты и/или другие (например, семья, друзья, коллеги по работе), но не настолько серьезны, чтобы мешать основным жизненным навыкам. Человек с MCI будет иметь значительно более низкие баллы, чем другие люди того же возраста, по нейропсихологическим показателям затронутых когнитивных областей (например, памяти, языка). Некоторые исследования показывают, что до 10-20% пожилых людей в возрасте 65 лет и старше имеют ЛКН. ЛКН может быть вызвана различными заболеваниями и состояниями психического здоровья (например, депрессией), а также быть предшественником прогрессирующей деменции, такой как БА. Со временем у большинства людей с диагнозом MCI прогрессирует (или «конвертируется») болезнь AD. В целом, исследования показывают, что 10-15% людей с MCI прогрессируют до AD каждый год. Однако по неизвестным причинам состояние некоторых людей с MCI остается стабильным, а состояние некоторых даже улучшается. Визуализация мозга и исследования биомаркеров у людей с MCI могут помочь исследователям обнаружить ранние изменения мозга, подобные тем, которые наблюдаются при AD, и помочь в определении прогноза для пациентов с MCI.
В целом, исследования показывают, что 10-15% людей с MCI прогрессируют до AD каждый год. Однако по неизвестным причинам состояние некоторых людей с MCI остается стабильным, а состояние некоторых даже улучшается. Визуализация мозга и исследования биомаркеров у людей с MCI могут помочь исследователям обнаружить ранние изменения мозга, подобные тем, которые наблюдаются при AD, и помочь в определении прогноза для пациентов с MCI.
Типы ЛКВ
Врач может диагностировать у пострадавшего человека один из следующих подтипов ЛКВ:
- Амнестический или неамнестический ЛКВ: При амнестическом ЛКВ память значительно нарушена. Другие когнитивные функции сохранены. Считается, что болезнь Альцгеймера вызывает амнестический MCI. При неамнестических MCI память остается неповрежденной, но одна (однодоменная) или несколько (многодоменная) других когнитивных способностей (например, язык, зрительно-пространственные навыки, исполнительные функции) значительно нарушены.

- Однодоменный MCI против Многодоменного MCI: В однодоменном MCI нарушена только память или один другой домен познания. При MCI с несколькими доменами затрагиваются память и одна или несколько других когнитивных способностей.
Лица с амнестической MCI, одно- или многодоменной, могут подвергаться повышенному риску развития деменции Альцгеймера. Лица с неамнестической MCI могут подвергаться повышенному риску других деменций, таких как лобно-височная деменция, деменция с тельцами Леви, первично-прогрессирующая афазия и болезнь Паркинсона. Наличие нескольких доменов MCI, по-видимому, увеличивает риск развития деменции в будущем.
Сегодня исследователи и клиницисты не могут точно предсказать, будет ли MCI прогрессировать до слабоумия. В настоящее время проводятся многочисленные исследования для выявления тех нейропсихологических, нейропсихиатрических, визуализационных и других особенностей MCI, которые могут указывать на риск дальнейшего снижения.
Каковы причины легких когнитивных нарушений (MCI)?
Что вызывает легкие когнитивные нарушения?
У некоторых людей MCI является состоянием, предшествующим деменции. Это означает, что заболевания головного мозга, вызывающие деменцию, уже установлены. Эти заболевания, как правило, необратимы, поэтому со временем симптомы у этих людей будут ухудшаться, и их состояние будет прогрессировать от ЛКН до деменции.
Например, у некоторых людей с MCI наблюдается легкая потеря памяти, которая начинается постепенно. У этих людей может развиться болезнь Альцгеймера по мере ухудшения их памяти.
У некоторых людей с ЛКН после осмотра врачом обнаруживается другая, часто излечимая причина. Это может включать депрессию, тревогу или стресс. Те же симптомы могут быть вызваны физическим заболеванием (например, запором, инфекцией), плохим зрением или слухом, дефицитом витаминов или щитовидной железы или побочными эффектами лекарств. В этом случае у человека будет диагностировано это состояние — например, недостаточность щитовидной железы или депрессия, — а не MCI.
Даже после тщательного обследования врач не всегда может сказать, что вызывает ЛКН. Может потребоваться подождать несколько месяцев или больше, чтобы увидеть, как развиваются симптомы у человека.
У скольких людей с ЛКН развивается деменция?
Люди с MCI подвергаются повышенному риску развития деменции. В исследованиях, проведенных в клиниках памяти, у 10-15% людей, у которых был MCI с постепенной потерей памяти, ежегодно развивалась деменция — обычно болезнь Альцгеймера.
В исследованиях, проведенных в других условиях, частота «конверсии» УКН в деменцию составляет примерно половину этого уровня (около 5% каждый год), но люди с УКН по-прежнему демонстрируют значительно повышенный риск развития деменции.
Хотя ЛКН увеличивает риск развития деменции, не у всех с ЛКН прогрессирует ухудшение состояния и развивается деменция. Некоторые люди с MCI остаются стабильными с течением времени, а некоторые улучшаются и больше не имеют никаких проблем.
Исход, как правило, зависит от причины MCI.
Эти разные результаты являются одной из причин, по которой некоторые врачи считают некоторые аспекты MCI спорными.
Можем ли мы определить людей, у которых разовьется слабоумие?
Многие исследования были сосредоточены на попытках определить, у каких людей с ЛКН разовьется деменция. Если бы это можно было предсказать, это означало бы, что людям можно было бы предложить широкий спектр поддержки на ранних стадиях развития деменции. В будущем, например, исследователи могут разработать лекарства для предотвращения прогрессирования ЛКН в деменцию.
Большинство исследований, направленных на прогнозирование того, у каких людей с MCI разовьется деменция, были сосредоточены на болезни Альцгеймера. Это потому, что это наиболее распространенная причина деменции, а также наиболее изученная. Имеются убедительные доказательства того, что простые тесты, основанные на изучении списков слов, достаточно хорошо помогают предсказать, у кого разовьется болезнь Альцгеймера.
