Индуктивный эффект
Индуктивный эффект (I-эффект)
Известно, что полярная ковалентная связь образуется между атомами с различной электроотрицательностью. Наличие в молекуле полярной σ-связи вызывает поляризацию ближайших двух–трех σ-связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ (дельта минус) на соседних атомах. Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов (δ), индуцируемых заместителем (X или Y):
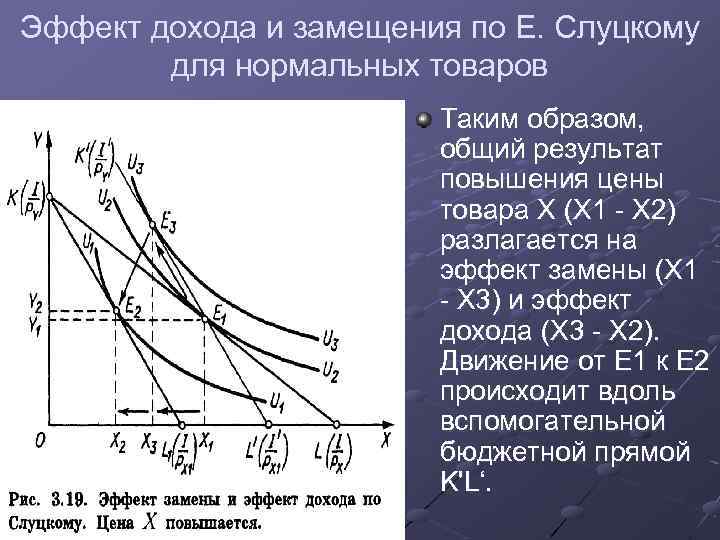
Таким образом, заместители вызывают поляризацию не только «своей», но и соседних связей. Такой вид передачи влияния атомов, приводящий к поляризации ковалентных связей и индуцированию зарядов на атомах, называется индуктивным (индукционным) электронным эффектом.
Индуктивный эффект (I-эффект) — смещение электронной плотности по цепи σ-связей, обусловленное различием электроотрицательностей атомов.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным 0.
Влияние заместителя на реакционный центр может передаваться не только по цепи σ-связей, но и непосредственно через пространство или через молекулы растворителя по механизму диполь-дипольного взаимодействия.
- Передача влияния заместителя через пространство или через растворитель называется эффектом поля (F-эффектом).
Как правило, эффект влияния заместителя через σ-связи и эффект поля действуют совместно и определить вклад каждого из них практически невозможно. Поэтому принято считать
Индуктивный эффект называют отрицательным (–I), если заместитель уменьшает электронную плотность на атоме углерода, с которым связан этот заместитель. При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода частичный положительный заряд (δ+).
При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода частичный положительный заряд (δ+).
Например:
Индуктивный эффект называется
Направление (знак) I-эффекта заместителя качественно оценивается путем сравнения со стандартом атомом водорода, индуктивный эффект которого принят равным 0.
- –I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом водорода. К ним относятся многие функциональные группы (галогены, -OH, -OR, -NH2, -NO2, >C=O, -COOH и др.), ненасыщенные группировки (например, -СH=CHR, -C≡CR) и катионы. Такие заместители в целом снижают электронную плотность на остальной части молекулы, то есть являются
- Величина –I-эффекта растёт с увеличением положительного заряда заместителя. Поэтому катионы индуцируют наиболее сильные и дальнодействующие эффекты:
- –I-эффект тем сильнее, чем больше электроотрицательность соответствующего гетероатома:
–NR
–CR=NR < –CR=O. - Непредельные заместители вызывают –I-эффект, который увеличивается с ростом степени их ненасыщенности:
–CR=CR2 < –CR=CR–CH=CH2 < –C6H5 < –C≡CR;
–CR=NR < –C≡N. - Величина +I-эффекта растет с увеличением отрицательного заряда заместителя. Поэтому анионы проявляют наиболее сильные и дальнодействующие эффекты:
- +I-эффект заместителя тем сильнее, чем меньше электроотрицательность соответствующего гетероэлемента:
- Алкильные группы проявляют относительно слабый +I-эффект, обусловленный суммарным действием слабополярных связей С–Н(С
-СН3 < -CH2-CH3 < -CH(CH3)2 < -C(CH3)3 В +I-эффекте трет-бутильной группы -C(CH3)3 суммируются полярности 9 связей С–Н.
+I-эффект характерен для заместителей, содержащих атомы с относительно низкой электроотрицательностью: металлов (например, -Mg-, -Li), алкильных радикалов (-CH3, -C2H5 и т.п.) и анионов.
Заместители, проявляющие +I-эффект, ведут к повышению электронной плотности в цепи и проявляют 
-Na > -MgR > -AlR2 > -SiR3
5.
 1.1. Индуктивный эффект.
1.1. Индуктивный эффект.10
ЛЕКЦИЯ 5
Схема лекции.
5.1. Электронные эффекты в органической химии.
5.1.1. Индуктивный эффект.
5.1.2. Эффекты сопряжения.
5.1.3. Резонанс.
5.2.1. Кислоты Бренстеда.
5.2.2. Основания Бренстеда.
5.2.3. Кислоты и основания Льюиса.
5.1. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКОЙ ХИМИИ.
Химические свойства
органических веществ различных рядов
и классов определяются особенностями
распределения электронной плотности
в молекулах этих веществ, что в свою
очередь определяется строением молекул
и наличием функциональных групп. Строение
функциональных групп и природа атомов,
входящих в их состав находят свое
отражение в так называемых электронных
эффектах.
Среди свойств ковалентной связи отмечалось свойство полярности, что выражается в смещении пары электронов, образующих связь в строну более электроотрицательного атома. Мерой полярности ковалентной связи является дипольный момент. Дипольный момент связи оказывает воздействие на соседнюю связь. Эта связь в свою очередь оказывает воздействие на соседнюю связь и т.д. В итоге происходит смещение электронных облаков химических связей вдоль линии σ-связей, вызванное различием в значениях электроотрицательности атомов. Это явление смещения получило название индуктивного эффекта.
Определение: Индуктивным
эффектом называется смещение электронной
плотности σ-связей вдоль линии связи,
вызванное различием в значениях
электроотрицательности атомов.
Индуктивный
эффект имеет электростатическую природу.
Он передается по линии связи и ведет к
появлению дробных электрических зарядов
на атомах. Заряды обозначаются символами
δ
Индуктивный эффект передается по цепи σ-связей с затуханием. Наиболее подвержен действию индуктивного эффекта α-углеродный атом.
Заместители,
притягивающие электроны, характеризуют
отрицательным индуктивным эффектом.
Их называют электроноакцепторными
заместителями.
Заместители, отталкивающие электроны от себя проявляют положительный индуктивный эффект (+I-эффект). Такие заместители называются электронодонорными. Положительный индуктивный эффект также определяется относительно метильной группы. Положительным индуктивным эффектом обладают атомы металлов, а также разветвленные алкильные группы:
Заместители,
в которых находится атом углерода в
состояниях sp2-гибридизации
и sp-гибридизации являются электроакцепторами
по сравнению с атомом углерода в состоянии
sp3-гибридизации
и, соответственно, обладают отрицательным
индуктивным эффектом.
Атомы с целым отрицательным зарядом обладают положительным индуктивным эффектом:
Атомы с целым положительным зарядом обладают отрицательным индуктивным эффектом.
Осуществление влияния природы атомов на распределение электронной плотности в молекуле возможно как по системе σ-связей посредством индуктивного эффекта, так и по системе π-связей. Способность π-электронов к смещению особенно ярко выражена в соединениях, в которых существует система чередующихся кратных и простых связей:
Такие соединения построены только из атомов в состоянии sp2-гибридизации. А сами такие системы называются сопряженными. Физической основой сопряжения является взаимодействие (перекрывание) р-орбиталей соседних двойных связей:
Сопряженная
система представляет собой сплошную
π-связь только электронная плотность
концентрированна в большей степени на
двойной связи и в меньшей степени на
простой связи. Т.е. в случае сопряженной
системы отсутствуют разрывы в цепочке
связей как в случае σ-остова. Соответственно
в случае появления в сопряженной системе
атома, электроотрицательность которого
отличается от электроотрицательности
атома углерода в состоянии sp2-гибридизации,
то в зависимости от того донором или
акцептором является функциональная
группа – произойдет смещение электронной
плотности по всей цепи сопряжения.
Эффект смещения электронной плотности
по цепи сопряжения называется мезомерным
эффектом (обозначается буквой «М»). В
зависимости от направления смещения
электронной плотности от заместителя
или к нему различают положительный
мезомерный эффект (+М) и отрицательный
мезомерный эффект (-М). Графически
мезомерные эффекты обозначается
изогнутой стрелкой Часто термин
«мезомерный эффект» заменяют термином
«эффект сопряжения». Но сопряжение
обозначает перекрывание орбиталей
соседних связей, а мезомерия обозначает
передачу влияния по цепи сопряженных
связей:
Т.е. в случае сопряженной
системы отсутствуют разрывы в цепочке
связей как в случае σ-остова. Соответственно
в случае появления в сопряженной системе
атома, электроотрицательность которого
отличается от электроотрицательности
атома углерода в состоянии sp2-гибридизации,
то в зависимости от того донором или
акцептором является функциональная
группа – произойдет смещение электронной
плотности по всей цепи сопряжения.
Эффект смещения электронной плотности
по цепи сопряжения называется мезомерным
эффектом (обозначается буквой «М»). В
зависимости от направления смещения
электронной плотности от заместителя
или к нему различают положительный
мезомерный эффект (+М) и отрицательный
мезомерный эффект (-М). Графически
мезомерные эффекты обозначается
изогнутой стрелкой Часто термин
«мезомерный эффект» заменяют термином
«эффект сопряжения». Но сопряжение
обозначает перекрывание орбиталей
соседних связей, а мезомерия обозначает
передачу влияния по цепи сопряженных
связей:
Комбинация
изогнутых стрелок по структурной формуле
отражает перераспределение электронной
плотности в цепи сопряжения. Данное
перераспределение называется
делокализацией «размазыванием». Иногда
делокализацию изображают графически
пунктирной линией по структурной
формуле:
Данное
перераспределение называется
делокализацией «размазыванием». Иногда
делокализацию изображают графически
пунктирной линией по структурной
формуле:
Такие формулы называют мезомерными формулами. Делокализация оказывает большое влияние на свойства сопряженных молекул. Чем выше степень делокализации тем выше термодинамическая стабильность сопряженной системы. Обратите внимание на порядок в своих комнатах. Чаще бывает беспорядок. Т.е. беспорядок более устойчивое состояние. Делокализация — то беспорядок в распределении электронов. Частным случаем делокализации является сверхсопряжение, которое способствует стабилизации неспаренных электронов алкильных радикалов.
Эффекты сопряжения характерны для соединений с кратными связями (двойные, тройные) независимо от природы атомов, соединенных кратными связями, а также для функциональных групп в состав которых входят гетероатомы с неподеленными электронными парами.
Индуктивный эффект – типы индуктивного эффекта, применение, стабильность
Индуктивный эффект относится к явлению, при котором в данной молекуле возникает постоянный диполь из-за неравного распределения связывающих электронов в молекуле.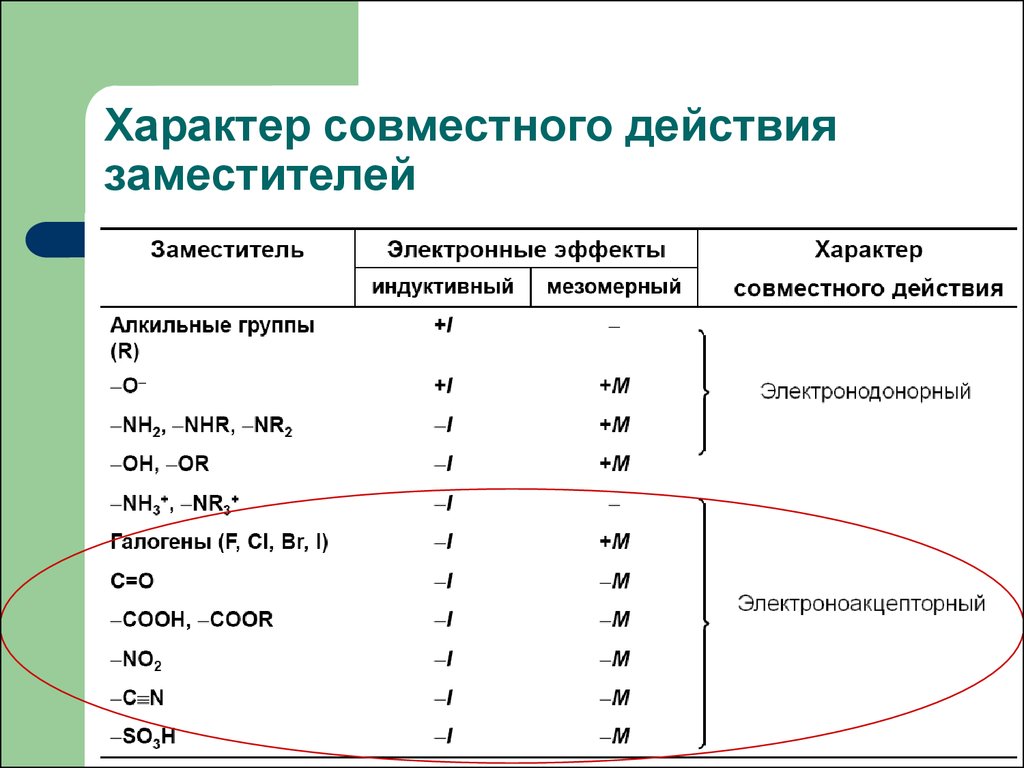 Этот эффект может возникать в сигма-связях, тогда как электромерный эффект может возникать только в пи-связях.
Этот эффект может возникать в сигма-связях, тогда как электромерный эффект может возникать только в пи-связях.
JEE Main 2021 LIVE Chemistry Paper Solutions 24 февраля Shift-1 На основе памяти
Содержание
- Влияние на кислотность и щелочность
- Типы индуктивного эффекта
- Влияние на стабильность
- Применение индуктивного эффекта
- Электромерный и индуктивный эффект
- Как проверить кислотность соединений?
Что такое индуктивный эффект?
Когда в цепочку атомов (как правило, углеродную цепь) вводят электрон-высвобождающие или электрон-акцепторные вещества, соответствующий отрицательный или положительный заряд передается через углеродную цепь принадлежащими ей атомами. Это приводит к возникновению постоянного диполя в молекуле и называется индуктивным эффектом.
Выше приведена иллюстрация, описывающая индуктивный эффект, возникающий в молекуле хлорэтана за счет более электроотрицательного атома хлора.
Читайте также
- Введение в органическую химию
- Очистка органических соединений
- Тест Лассена
- Метод Виктора Мейера
Индуктивное влияние на кислотность и щелочность
Используя индуктивный эффект, мы можем предсказать кислотность и основность соединений. В качестве обобщения можно сказать, что электроноакцепторные группы (EWG) повышают кислотность соединения, а электронодонорная группа снижает кислотность соединения.
Это связано с тем, что если взять сопряженное основание кислоты, то есть RCOO-, если R электроноакцепторный, то сопряженное основание стабилизируется за счет делокализации образовавшегося отрицательного заряда.
Если бы R был электронодонорным, то сопряженное основание было бы дестабилизировано из-за межэлектронного отталкивания.
Таким образом, можно сказать, что группы +I уменьшают кислотность (или повышают основность), а группы –I повышают кислотность (или уменьшают основность) соединений.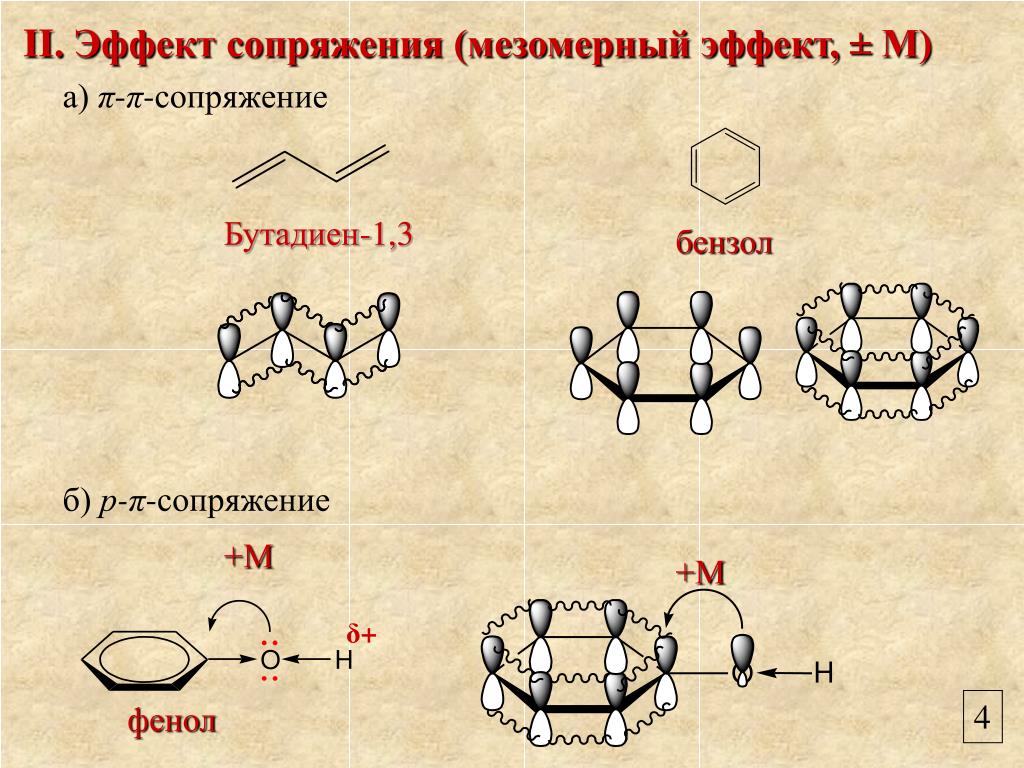
Например, , муравьиная кислота (HCOOH) более кислая, чем уксусная кислота (Ch4COOH) из-за +I индуктивного эффекта метильной группы, присоединенной к группе карбоновой кислоты.
Примечание: Если Ka кислоты высокое, это сильная кислота, но если PKa кислоты высокое, говорят, что это слабая кислота [pka = -log(ka)]. Та же логика применима и к базам.
Рассмотрите кислотность моно-, ди- и трихлоруксусной кислоты.
Можно сказать, что присутствие трех атомов Cl делает кислород сильно электронодефицитным и, таким образом, максимально поляризует связь O-H. Следовательно, порядок кислотности для вышеуказанных соединений будет III > II > I.
Типы индуктивного эффекта
- Отрицательный индуктивный эффект или эффект -I
- Положительный индуктивный эффект +I-эффект
-I-эффект (отрицательный индуктивный эффект)
Когда электроотрицательный атом, такой как галоген, вводится в цепочку атомов (как правило, атомов углерода), в результате неравного распределения электронов образуется положительный заряд, который передается по цепи.
Это приводит к возникновению постоянного диполя в молекуле, в которой электроотрицательный атом имеет отрицательный заряд, и соответствующий эффект называется электроноакцепторным индуктивным эффектом или эффектом -I.
Эффект +I (положительный индуктивный эффект)
Когда химическое соединение с тенденцией высвобождать или отдавать электроны, такое как алкильная группа, вводится в углеродную цепь, заряд передается по цепи, и этот эффект называется положительным индуктивным эффектом или эффектом +I.
Индуктивное влияние на стабильность молекул
Заряд данного атома и заряд группы, связанной с атомом, играет важную роль при определении стабильности полученной молекулы в соответствии с индуктивным эффектом.
Пример этого можно наблюдать, когда группа, проявляющая эффект -I, связана с положительно заряженным атомом, и положительный заряд полученной молекулы усиливается, снижая ее стабильность.
С другой стороны, когда отрицательно заряженный атом вводится в группу, проявляющую -I-эффект, неравенство зарядов несколько гасится, и получающаяся в результате молекула будет стабильна в соответствии с индуктивным эффектом.
Также,
Когда группа, проявляющая эффект -I, связана с молекулой, электронная плотность полученной молекулы эффективно снижается, что повышает вероятность ее принятия электронов и, таким образом, увеличивает кислотность молекулы.
Когда группа +I присоединяется к молекуле, происходит увеличение электронной плотности молекулы. Это увеличивает основность молекулы, поскольку теперь она более способна отдавать электроны.
Применение индуктивного эффекта
Рисунок 1:
Укажите устойчивость следующих канонических форм.
Структуры I и III имеют больше ковалентных связей и более стабильны, чем II и IV. Между I и III I более стабилен, потому что отрицательный заряд находится на электроотрицательном элементе.
Между II и IV II более стабилен по той же причине, что и выше.
Порядок I > III > II > IV
Иллюстрация 2:
Мы знаем, что EWG повышает кислотность, а EDG снижает кислотность.
-Me представляет собой группу +I, тогда как -OMe представляет собой группу +R, поэтому -OMe снижает кислотность сильнее, чем -Me.
Следовательно, порядок такой: d>c>e>a>b
Поскольку ka прямо пропорциональна кислотности, ответ будет следующим: a→t, b→p, c→s, d→q, e→r.
Иллюстрация 3:
Решение: NaNh3 является основанием; следовательно, наиболее кислый протон субстрата будет реагировать с образованием сопряженного основания. Идея здесь состоит в том, чтобы найти самый кислотный протон.
Всего имеется четыре протона: -COOH, -OH, нитрозамещенный -OH и алкиновый протон.
Поскольку используются два моля основания, в реакцию будут вступать два протона.
Порядок кислотности протонов
-COOH>-OH (нитрозамещенный)>-OH> ацетиленовый протон
Таким образом, продукт будет
.
Иллюстрация 4: Порядок кислотности следующих соединений
Решение: Чтобы узнать кислотность соединений, удалите протон и проверьте стабильность образовавшегося сопряженного основания.
ЦБ структур I и II стабилизированы внутримолекулярной водородной связью (I больше, чем II).
Между мета- и пара-изомером мета будет более кислым из-за -I эффекта кислорода.
Следовательно, порядок I>II>III>IV
Рисунок 5:
Решение: Наиболее основным из четырех является I. Это связано с тем, что структуры II и IV являются ароматическими. Между I и III I является более основным из-за присутствия атома кислорода в III, который снижает основность за счет эффекта -I.
Между II и IV II будет более основным, потому что в IV неподеленная пара азота делокализована, что делает соединение ароматическим. Недоступность одинокой пары для донорства делает IV наименее базовой.
Следовательно, порядок I > III > II > IV.
Индуктивный эффект против Электромерного эффекта
Столбец в виде таблицы, отражающий основные различия между электромерным и индуктивным эффектами, можно найти ниже.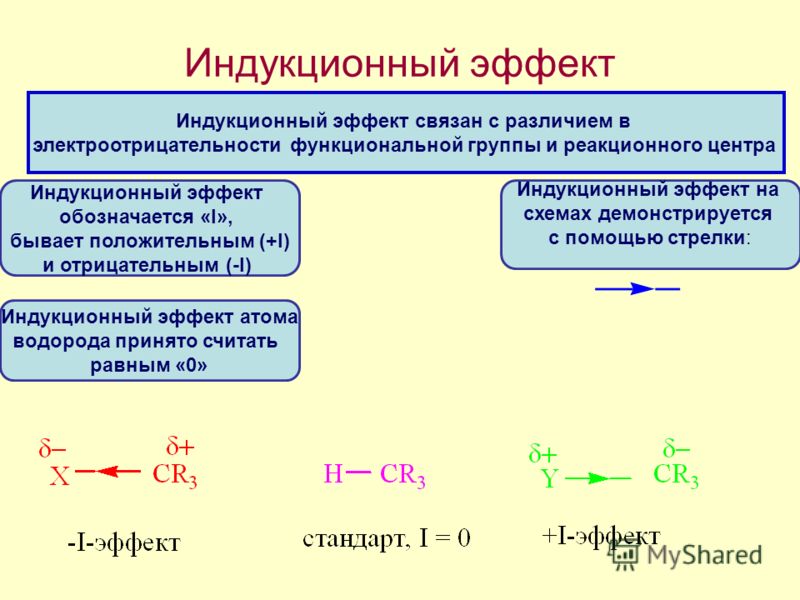
| Индуктивный эффект | Электромерный эффект |
| Работы на сигма-облигациях | Работы по пи-облигациям |
| Индуктивный эффект постоянный | Электромерный эффект является временным эффектом |
| Не требует агрессивного реагента | Для возникновения этого эффекта требуется электрофильный атакующий реагент |
Таким образом, можно понять, что эффекты +I и -I играют жизненно важную роль в стабильности, а также в кислотности или основности молекул.
Как проверить кислотность органических и ненасыщенных соединений?
Чтобы проверить кислотность органического соединения, удалите протон, а затем проверьте стабильность образовавшегося таким образом сопряженного основания. Чем стабильнее сопряженное основание, тем сильнее кислота.
Чтобы проверить наличие кислотности среди ненасыщенных соединений, проверьте гибридизацию задействованного углерода. Чем больше s-характера у углерода, тем больше его электроотрицательность и, следовательно, больше кислотность.
Чем больше s-характера у углерода, тем больше его электроотрицательность и, следовательно, больше кислотность.
Следовательно, наиболее кислым среди алкинов, алкенов и алканов является Алкины > Алкены > Алканы
Если существует конкуренция между двумя группами, оттягивающими электроны через резонанс и через индукцию, предпочтение отдается резонансу, поскольку он влияет на всю молекулу.
ИНДУКТИВНЫЙ ЭФФЕКТ-Положительный-Отрицательный-Определение-Примеры-Применения
Поляризация σ-связи из-за электрона акцепторный или электронодонорный эффект соседних групп или атомов относится к как индуктивный эффект .
Сигма-связь между двумя атомами, различающимися по своей электроотрицательности,
поляризуется за счет смещения пары связей в сторону более
электроотрицательный атом. В этом процессе электроотрицательный атом частично
отрицательный заряд, в то время как другой атом получает частичный положительный заряд.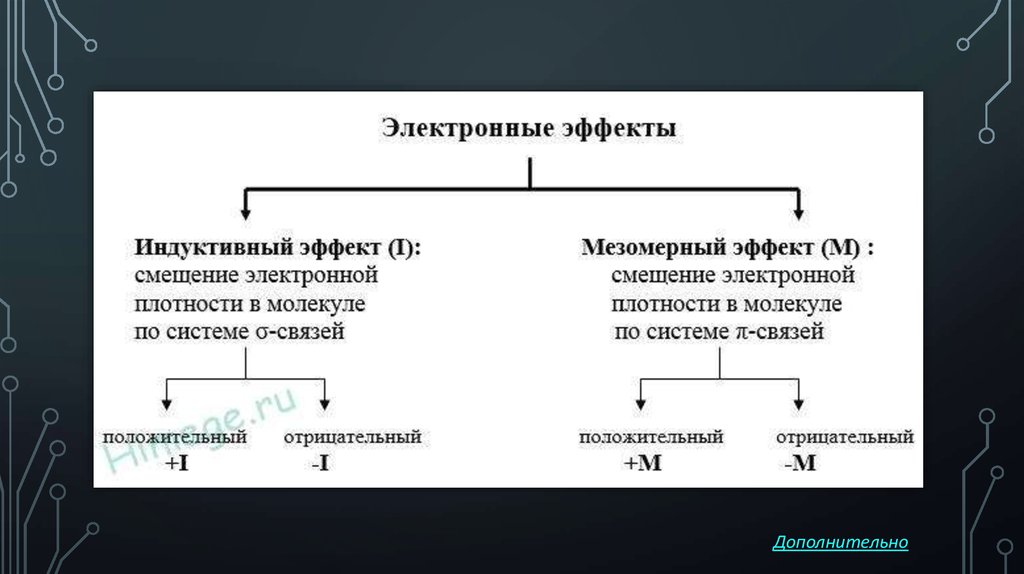 Таким образом
индуцированная полярность передается через сигма-связи в молекуле
создание постоянного диполя. Это явление называется индуктивным
эффект.
Таким образом
индуцированная полярность передается через сигма-связи в молекуле
создание постоянного диполя. Это явление называется индуктивным
эффект.
Обозначается стрелкой, указывающей на более электроотрицательный атом, несущий частичный отрицательный заряд.
Характерные особенности индуктивного эффекта
* Возникает из-за разницы электроотрицательностей между двумя атомами, образующими сигма-связь.
* Передается через сигма-связей . Пи-связей нет вовлеченный.
* Величина индуктивного эффекта уменьшается при удалении от группы, его вызывающие.
* Это постоянный эффект . Это может создать постоянный диполь в молекуле.
* В целом индуктивный эффект относительно слабый и затмевается другими электронными эффектами, такими как резонанс эффект, гиперконъюгация и др.
* Влияет на химические и физические свойства соединений.
Связь C-Cl в бутилхлориде, CH 3 -CH 2 -CH 2 -CH 2 -Cl поляризуется из-за разницы в электроотрицательности. Электроны оттягиваются атом хлора. Таким образом, первый атом углерода получает частичный положительный заряд. В В свою очередь, этот атом углерода частично увлекает электронную плотность от соседнего углерода, который также получает частичный положительный заряд. Это будет продолжаться и дальше, и именно так проявляется индуктивный эффект. передается по углеродной цепи.
Следует отметить, что индуктивный эффект ослабевает по цепочке и не настолько значительно за 3-м атомом углерода.
Также обратите внимание, что индуктивный эффект является постоянным эффектом и присущ
молекула, в то время как электромерный эффект является временным эффектом только
создается в присутствии атакующих электрофильных или нуклеофильных реагентов.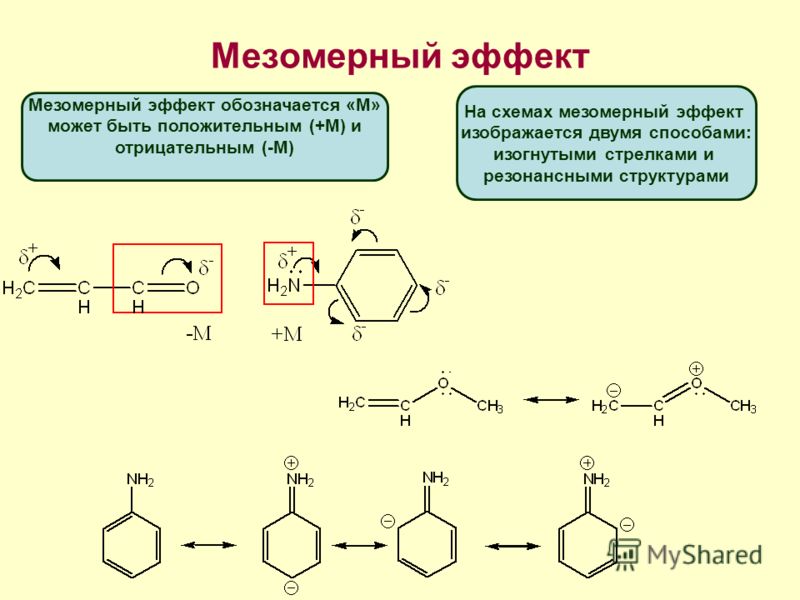
Индуктивный эффект делится на два типа в зависимости от электроноакцепторная или электроноотдающая природа атома/группы, индуцирующей его. сила индуктивного эффекта измеряется путем сравнения с силой водорода.
1) Отрицательный индуктивный эффект (-I):Электроноакцепторная природа групп или атомов называется отрицательным индуктивным эффектом. Обозначается -I. Ниже приведены примеры групп в порядке убывания их эффекта -I:
NH 3 + > NO 2 > CN > SO 3 H > CHO > CO > COOH > COCl > CONH 2 > F > Cl > Br > I > OH > OR > NH 2 > С 6 Н 5 > H
2) Положительный индуктивный эффект (+I):Относится к высвобождению электронов природа групп или атомов и обозначается +I. Ниже приведены примеры групп в порядке убывания их эффекта +I.
C(CH 3 ) 3 > CH(CH 3 ) 2 > CH 2 CH 3 > канал 3 > H
Почему алкильные группы проявляют положительный индуктивный эффект?
Хотя связь C-H практически считается неполярной, существует частичная
положительный заряд на атоме водорода и частичный отрицательный заряд на атоме углерода. Поэтому каждый атом водорода действует как электронодонорная группа. Этот совокупный
донорство превращает алкильный фрагмент в электронодонорную группу.
Поэтому каждый атом водорода действует как электронодонорная группа. Этот совокупный
донорство превращает алкильный фрагмент в электронодонорную группу.
Стабильность карбокатионов увеличивается, когда +I группы, такие как алкил группы присутствуют рядом с положительно заряженным углеродом. Группы +I уменьшают положительный заряд на углероде, пожертвовав отрицательную плотность заряда через положительный индуктивный эффект. Это приводит к большая стабильность карбокатиона.
Принимая во внимание, что группы -I дестабилизируют карбокатионы, поскольку они увеличивают положительный заряд за счет уменьшения электронной плотности.
Обратите внимание, что любой фактор, увеличивающий заряд (как отрицательный, так и
положительный) на ион приводит к дестабилизации, в то время как любой фактор, уменьшающий
заряд приводит к стабилизации этого иона.
Например, порядок стабильности некоторых карбокатионов, содержащих алкильные группы, следующий: следующим образом:
Третичный карбокатион, содержащий три алкильные группы, более стабилен, чем вторичный карбокатион с двумя алкильными группами, который, в свою очередь, более стабилен чем первичный карбокатион. Метилкарбокатион наименее стабилен среди данный.
Стабильность свободных радикалов:Таким же образом стабильность свободных радикалов увеличивается с увеличением количество алкильных групп.
Таким образом, устойчивость различных свободных радикалов равна:
Стабильность карбанионы:
Однако группы +I снижают стабильность карбанионов, в то время как группы -I групп повышает их устойчивость.
Например, алкильные группы (+I) отдают электронную плотность отрицательно заряженный углерод приводит к дестабилизации карбаниона.
Таким образом, порядок устойчивости следующих карбанионов:
Теперь порядок обратный.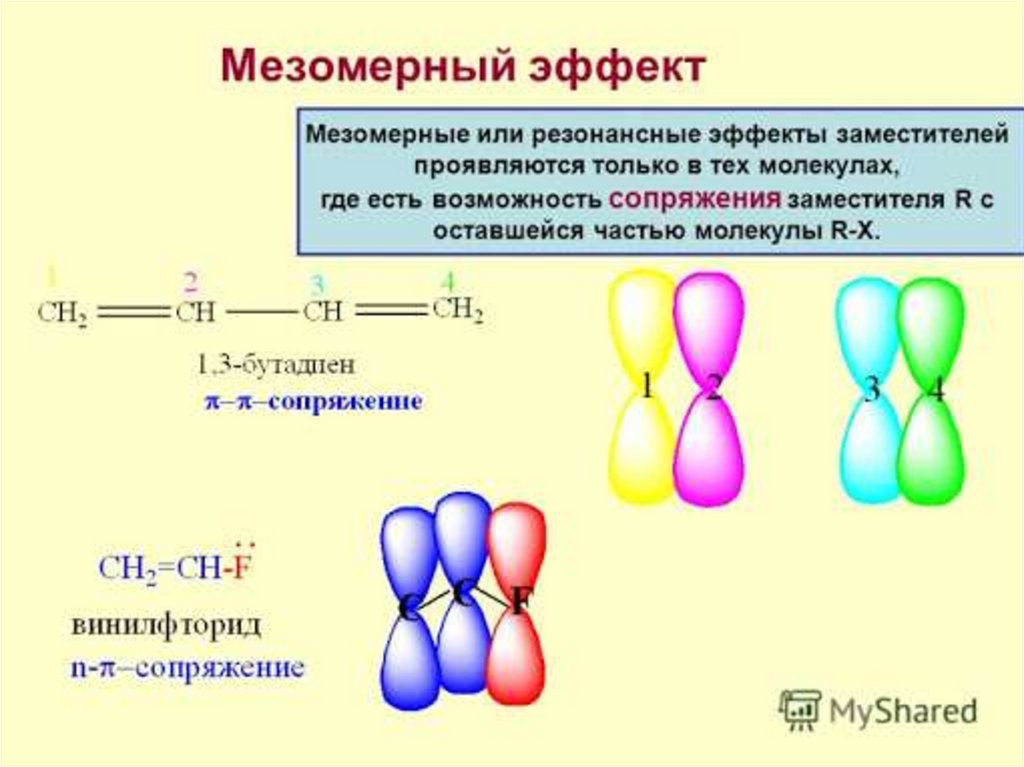 Третичный карбанион наименее стабилен, а
метилкарбанион наиболее стабилен среди приведенных.
Третичный карбанион наименее стабилен, а
метилкарбанион наиболее стабилен среди приведенных.
Протонная кислота всегда находится в равновесии со своим сопряженным основанием, т.е. образуется при потере протона. Любой фактор, стабилизирующий отрицательно заряженный сопряженное основание способствует большей ионизации кислоты. то есть увеличивает кислотность сила.
Электроноакцепторные группы, проявляющие отрицательный индуктивный эффект (-I), уменьшают отрицательный заряд на сопряженное основание (например, карбоксилат-ион), увеличивая плотность электронов и, таким образом, стабилизируя ее. Следовательно, кислотная сила увеличивается когда -I группы присутствуют.
Наоборот, группы +I уменьшают кислотную силу, так как они
дестабилизировать сопряженное основание кислоты (анионное), высвобождая электронную плотность
что, в свою очередь, увеличивает отрицательный заряд аниона и тем самым дестабилизирует
это.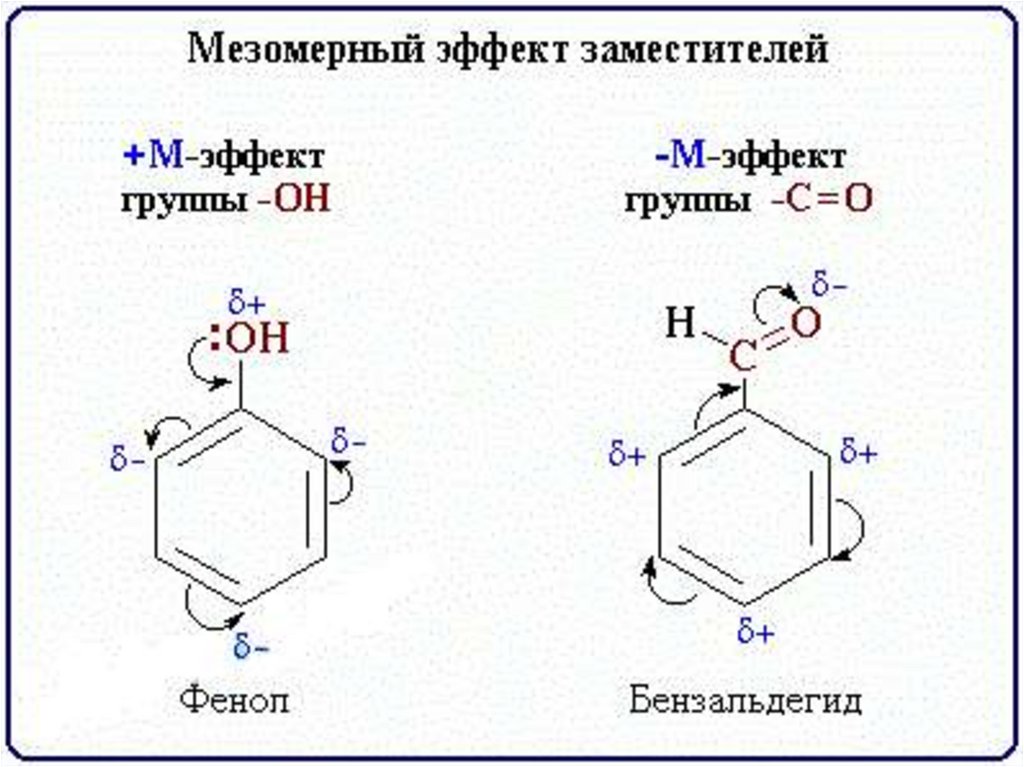
i) Кислотная сила увеличивается с увеличением количества электронов удаление атомов фтора, как показано ниже.
CH 3 COOH < CH 2 FCOOH < CHF 2 COOH < CF 3 COOH
ii) Муравьиная кислота является более сильной кислотой, чем уксусная кислота, поскольку –CH 3 группа дестабилизирует карбоксилат-ион.
Аналогичным образом кислотная сила фенолов увеличивается, когда -I группы присутствуют на ринге.
П-нитрофенол является более сильной кислотой, чем фенол, поскольку -NO 2 группа представляет собой группу -I, которая забирает электронную плотность. Принимая во внимание, что пара-крезол является более слабой кислотой, чем фенол, поскольку -CH 3 группа показывает положительный индуктивный эффект (+I).
Например, порядок кислотной силы после фенолов следующий:
- Основная сила аминов:
Электронодонорные группы, такие как алкильные группы, увеличивают основную силу
амины, тогда как электроноакцепторные группы, такие как арильные группы, уменьшают
основная природа.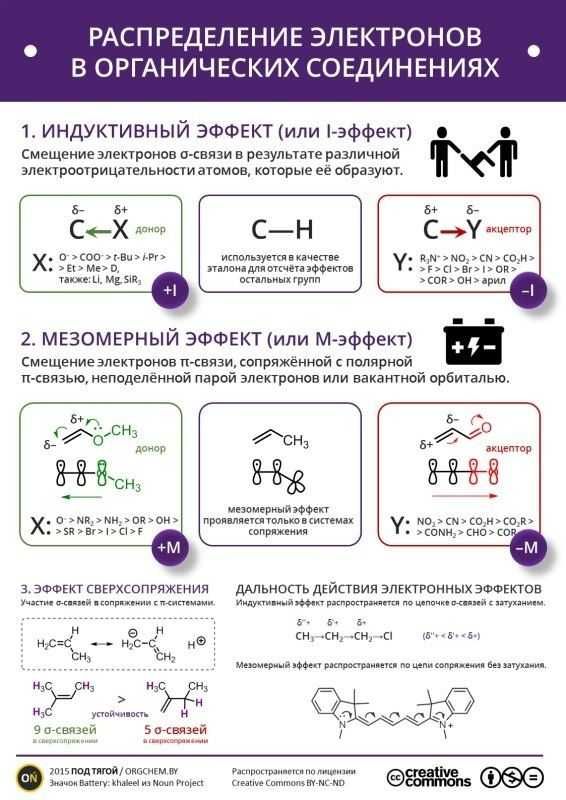 Следовательно, алкиламины являются более сильными основаниями Льюиса, чем аммиак.
тогда как ариламины слабее аммиака.
Следовательно, алкиламины являются более сильными основаниями Льюиса, чем аммиак.
тогда как ариламины слабее аммиака.
Таким образом, порядок основной силы алкил- и ариламинов по отношению к Аммиак: CH 3 NH 2 > NH 3 > C 6 H 5 NH 2
Реактивность CARBONYL: 1. группы увеличивают электронную плотность у карбонильного углерода. Отсюда их реактивность в сторону нуклеофилов уменьшается. Таким образом, формальдегид более реакционноспособен, чем ацетальдегида и ацетона к реакциям нуклеофильного присоединения.Таким образом, порядок реактивности следующий:
Вопрос: Что из следующего является применением индуктивный эффект?
1) Устойчивость карбокатионов
2) Основная сила аминов
3) Кислотная сила карбоновых кислот
4) Все перечисленное
Ответ: 4
эффект меньше влияет на , чем другие эффекты, такие как эффект резонанса и гиперконъюгация.
Напр. Электроноакцепторная природа нитрогруппы, -NO 2 , в основном из-за резонансного эффекта, а не индуктивного эффекта.
Но есть и исключения. Например, в случае галогенов отрицательный индуктивный эффект преобладает над положительным резонансным эффектом.
Вопрос-1) Индуктивный эффект лучше всего описать как:
а) сопряжение σ-связывающей орбитали с соседней π-орбиталью.
б) способность атома или группы вызывать поляризацию связи
в) перенос неподеленной пары электронов от более электроотрицательного атома к менее электроотрицательному атому в молекуле.
г) Все вышеперечисленное.
Ответ: b
Вопрос-2) Какое из следующих утверждений об индуктивном эффекте неверно?
а) Это постоянный эффект
б) Он уменьшается с увеличением
на расстоянии от полярной группы, вызывающей индуктивный эффект.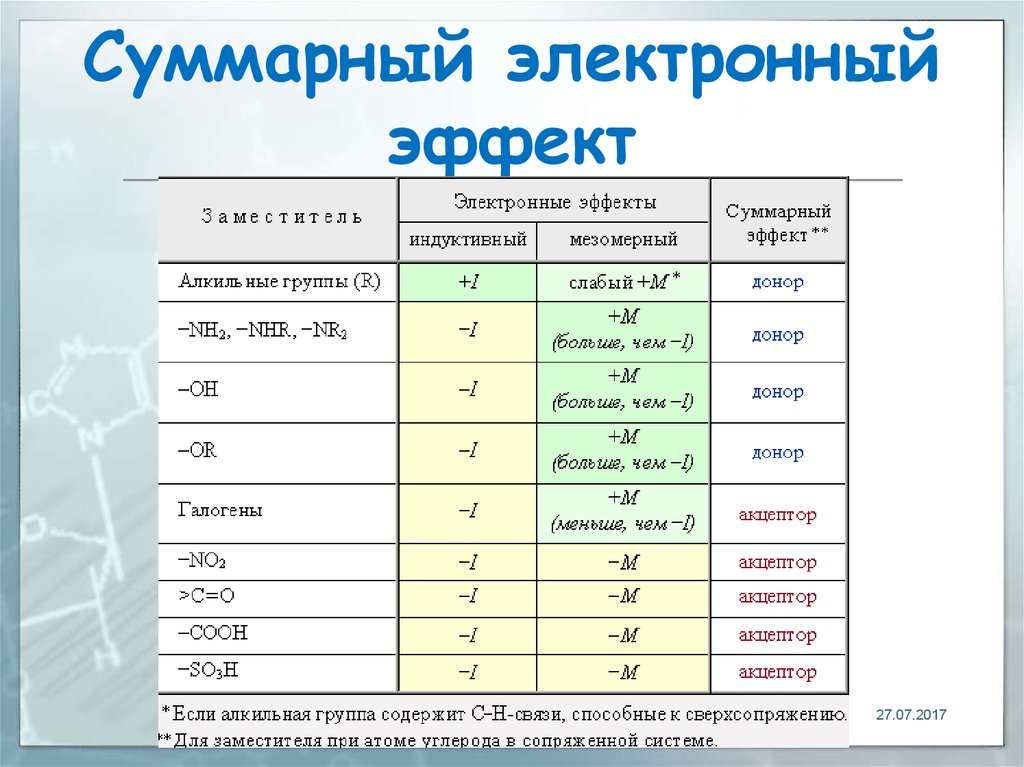
c) Включает делокализацию π-электронов
d) Включает смещение σ-электронов
Ответ: d
Вопрос-3) Что из нижеперечисленного демонстрирует положительный (+I) индуктивный эффект?
A)-NO 2
B) –OCH 3
C) –coOH
D) –CH 3
Ответ: D
Вопрос-4), который показывает следующую группу. отрицательный (-I) индуктивный эффект ?
а) –СН 2 CH 3
B) –C (Ch 3 ) 3
C) –C 6 H 5
9.
Вопрос-5) Какой из следующих порядков является правильным относительно -I влияние заместителей?
a) –NH 2 < –OR > –F
b) -CR 3 < –NR 2 < –OR < –F
c) -CR 3 > –NR 2 > –ИЛИ > –F
d) – + NR 3 > – + ИЛИ 2
Ответ: b
6) Правильный порядок относительно величины отрицательного индуктивный эффект для данных групп:
а) –SO 3 H > –SO 2 R > –SR > –SOR
б) –SR > –SO 2 R > – SOR > –SO 3 H
c) –SO 3 H > –SO 2 R > –SOR > –SR
d) –SR > –SOR > –SO 2 R > –SO 3 H
Ответ: c
Вопрос-7) Наиболее стабильным ионом карбония является:
a) CH 3 + 7 92 CH 99 902 b) CH 3902 2 + в) (СН 3 ) 2 СН + г) (СН 3 ) 3 С +
а) CH 3 • b) CH 3 CH 2 • c) (CH 3 )CH• d) (CH 3 ) 3 C•
Ответ: d
Вопрос-9) Правильный порядок кислотной силы данных кислот:
а) Муравьиная кислота > уксусная кислота > пропановая кислота
b) муравьиная кислота > уксусная кислота < пропановая кислота
c) муравьиная кислота < уксусная кислота > пропановая кислота
d) муравьиная кислота < уксусная кислота < пропановая кислота
Ответ: a
Вопрос-10) Правильный порядок кислотной силы:
a) CH 3 CH 2 CHFCOOH > CH 3 CHFCH 2 COOH > FCH 2 CH 2 CH 2 COOH
b) CH 3 CH 2 CHFCOOH < CH 3 CHFCH 2 9002 < FCH 2 CH 2 CH 2 COOH
c) CH 3 CH 2 CHFCOOH > CH 3 CHFCH 2 900 < ФЧ 2 CH 2 CH 2 COOH
d) CH 3 CH 2 CHFCOOH < CH 3 CHFCH 2 CO 7 > FCH 2 CH 2 CH 2 COOH
фторы и их удаленность от группы -COOH.
Вопрос-11) Какая из перечисленных кислот является самой сильной?
a) Cl 3 CCOOH
b) Cl 2 CHCOOH
c) ClCH 2 COOH
d) CH 3 COOH
Ответ: a
Вопрос-12) Какой из следующих карбанионов более стабилен?
а) СН 3 — б) СН 3 СН 2 — c) CF 3 CH 2 — d) (CH 3 ) 2 CH —
Ответ: c
Правильный порядок кислотной силы Вопрос-13ic) замещенных фенолов:
Ответ: 2
Вопрос-14) Каков характер %s при гибридизации углерода, когда он показывает сильнейший эффект -I ?
а) 25% б) 50% в) 75% г) 66,6%
Ответ: в
Информация: Электроотрицательность углерода увеличивается с
% s-орбитального признака в гибридизации. Таким образом, порядок
электроотрицательность: sp >sp 2 > sp 3 . Поэтому
углерод с sp-гибридизацией (как в алкинах) проявляет наибольшую индукционную
эффект.
Поэтому
углерод с sp-гибридизацией (как в алкинах) проявляет наибольшую индукционную
эффект.
Вопрос-15) Какой из следующих приказов является правильным в отношении кислотность карбоновых кислот?
а) (CH 3 ) 3 CCOOH > (CH 3 ) 2 CHCOOH > CH 3 CH 2 COOH
b) (CH 3 ) 3 CCOOH > (CH 3 ) 2 CHCOOH < CH 3 CH 2 COOH
c) (CH 3 ) 3 CCOOH < (CH 3 ) 2 СНСООН > CH 3 CH 2 COOH
d) (CH 3 ) 3 CCOOH < (CH 3 ) 2 CHCOOH < CH 3 CH 2 COOH
Question-16) The strongest Lewis base among the following is :
a) CH 3 NH 2
b) (CH 3 ) 2 NH
c) (CH 3 ) 3 N
d) C 6 H 5 NH 2
Вопрос-17) Укажите правильные утверждения об электроотрицательности
групп, указанных ниже: (CSIR NET ИЮНЬ 2018 г. )
)
(A) CF 3 Группа имеет большее значение, чем значение группы NF 2
(B) NH 2 Группа имеет более низкое значение, чем значение группы NF 2
(C) Группа OH имеет большую ценность, чем группа NF похожие значения
Правильный ответ:
1) A, B и D
2) B и C
3) B, C и D
4) B и D
Ответ: 4
Вопрос-18) Какой из следующее неверное утверждение о индуктивный эффект?
А) Электроноакцепторный индуктивный эффект (-I) группы ослабляет Связь O-H в -COOH и способствует ионизации карбоновой кислоты
B) Действует через пространство.
C) Анилин является более слабым основанием, чем аммиак, из-за отрицательного индукционного эффекта показано фенильной группой.
D) Алкильные группы являются хорошими примерами положительного индуктивного эффекта.
Ответ: B
Вопрос-19) Выберите правильное утверждение относительно индуктивного эффекта.
а) Усиливается с увеличением расстояния от атома или группы вызывая поляризацию.
b) Включает смещение одиночной пары.
c) Включает делокализацию пи-электронов.
d) Действует через σ-связи.
Ответ: d
Вопрос-20) Какая из следующих групп имеет наибольший индуктивный эффект.
а) Кл
б) Бр
в) Ф
г) И
Ответ: в
Вопрос-21) Какое из утверждений об индуктивных эффект правильный?
а) Также известен как гиперконъюгация.
b) Величина индуктивного эффекта увеличивается с увеличением расстояния из группы, вызывающей поляризацию.
в) с делокализацией π-электронов
г) с перемещением σ-электронов
Ответ: d
Вопрос-22) Какая из следующих групп показывает электрон снятие индукционного эффекта ?
a) –CH 2 CH 3
b) – NO 2
c) –C 6 H 5
d) –CH 3
Answer: b
Вопрос-23) индуктивный эффект в молекуле возникает за счет:
а) наличия неполярной связи
б) поляризации сигма-связи, примыкающей либо к электроноакцепторной, либо
электроноотдающая группа.
