Страница не найдена (ошибка 404)
- Родителям и ученикам
- Полезная информация
- Информационная безопасность
- Вакантные места для приема (перевода) обучающихся
- Помощь в трудной ситуации
- Будущим первоклассникам
- Правила приема, перевода, отчисления
- Детям с ограниченными возможностями здоровья
- Мероприятия
- Платные образовательные услуги
- Новости
- Каникулы
- Экзамены
- Секции и кружки
- Олимпиады и конференции
- Стипендии и меры поддержки обучающихся
- Услуги и сервисы
- Школьный театр «Лира»
- Школьный спортивный клуб «Факел»
- Полезная информация
- Наша школа
- О школе
- Администрация
- Педагогический состав
- Профильные направления
- История
- Математика
- Наши классы
- Доска почета
- Электронный журнал
- Образовательные ресурсы
- Профессиональные стандарты
- Аттестация педагогических работников
- Повышение квалификации
- Профсоюзная организация
- Вакансии
- Независимая оценка качества образования
- Независимая оценка качества условий образовательной деятельности
- Независимая оценка качества подготовки обучающихся
- Расписание
- Вопросы и ответы
- Контакты
«Социометрия интеллекта» как начальная методика выявления склонностей и способностей
Акбарова Санобар Нарзикуловна1, Исаханова Нигора Хикматовна2
1Ташкентский Педиатрический Медицинский институт (Узбекистан), кандидат психологических наук
2Ташкентский Педиатрический Медицинский институт (Узбекистан), ассистент
Аннотация
В статье анализируются результаты проведения методики «Социометрия интеллекта» у учащихся лицея города Ташкента. Выявлено достоверная корреляция между данными этой методики и успеваемостью учеников в виде четвертных оценок по предметам точных наук.
Выявлено достоверная корреляция между данными этой методики и успеваемостью учеников в виде четвертных оценок по предметам точных наук.
Ключевые слова: одарённость, профориентация, склонности, социометрия интеллекта, способности
Sanobar Narzikulovna Akbarova1, Nigora Hikmatovna Isahanova2
1Tashkent Pediatric Medical institute (Uzbekistan), PhD
2Tashkent Pediatric Medical institute (Uzbekistan), аssistant
Abstract
The article analyzes the results of the method «Sociometry of intelligence» at the Lycéum in Tashkent city. It was revealed significant correlation between the data of this method and student’s performance in the form of quarter estimates of the exact sciences.
Keywords: aptitudes, endowment, propensity, sociometry intelligence, vocational guidance
Библиографическая ссылка на статью:
Акбарова С.Н., Исаханова Н.Х.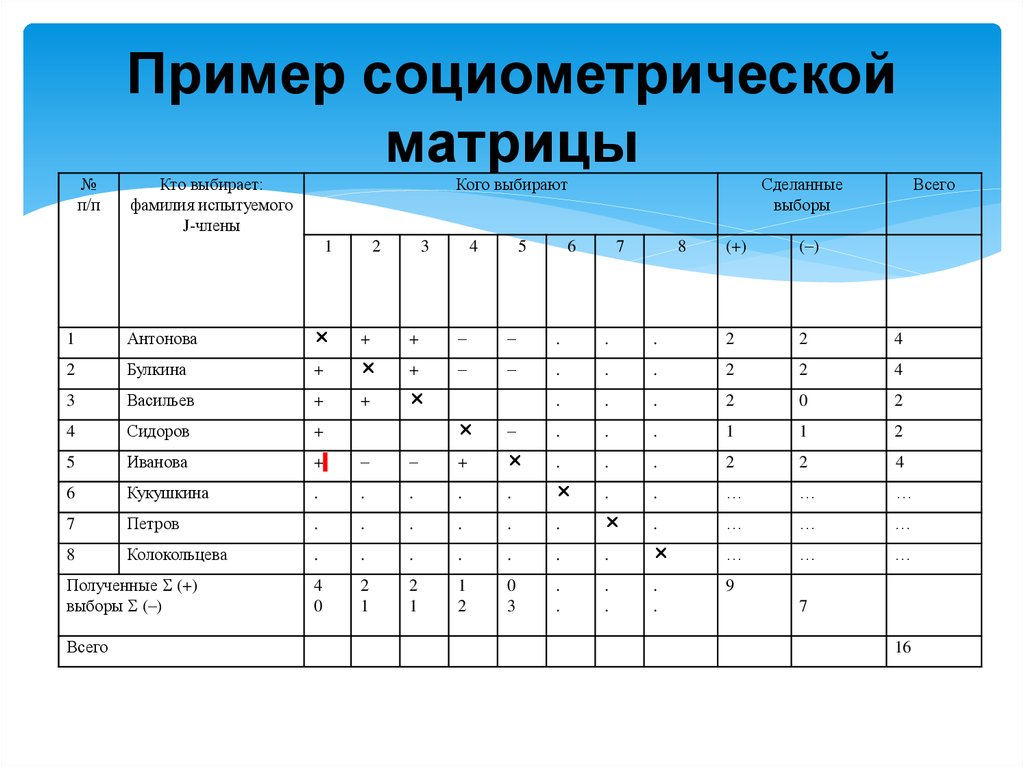 «Социометрия интеллекта» как начальная методика выявления склонностей и способностей // Современная педагогика. 2015. № 2 [Электронный ресурс]. URL: https://pedagogika.snauka.ru/2015/02/3375 (дата обращения: 02.03.2023).
«Социометрия интеллекта» как начальная методика выявления склонностей и способностей // Современная педагогика. 2015. № 2 [Электронный ресурс]. URL: https://pedagogika.snauka.ru/2015/02/3375 (дата обращения: 02.03.2023).
Изучение склонностей и способностей является важным аспектом психологии в плане профориентации и подготовки кадров. Поскольку профессиограмма каждой специальности требует определенных способностей [1].
На сегодняшний день для изучения склонностей и способностей разработано множество методик, где главным испытуемым является сам объект изучения, также существует альтернативный метод, где на опросник отвечают окружающие люди исследуемых объектов. Одной из таких методик является социометрия.
Метод социометрии разработанный французским учёным Ж.Морено [2] был очень популярным в 70-годы. В 1989 году эта методика была переработана и адаптирована в Ташкенте профессором Б.Р.Кадыровым [3] в целях отбора среди учеников средних школ сообразительных и активных учащихся. Первоначальный вариант этой методики имел 16 вопросов: 8 из которых выявлял тех, кто хорошо учиться по данным предметам, а остальные 8 вопросов направлены для выявления тех, кто мог бы хорошо учиться по этим же предметам. Последние 8 вопросов могли бы прогнозировать склонности к данным предметам. В процессе многолетних исследований количество и содержание вопросов были многократно изменены. В 1998 году данная методика имела 6 вопросов и под названием «Социометрия интеллекта» была первичным этапом в технологии отбора в «Центре одарённости», который функционирует существующее в городе Ташкенте.
Первоначальный вариант этой методики имел 16 вопросов: 8 из которых выявлял тех, кто хорошо учиться по данным предметам, а остальные 8 вопросов направлены для выявления тех, кто мог бы хорошо учиться по этим же предметам. Последние 8 вопросов могли бы прогнозировать склонности к данным предметам. В процессе многолетних исследований количество и содержание вопросов были многократно изменены. В 1998 году данная методика имела 6 вопросов и под названием «Социометрия интеллекта» была первичным этапом в технологии отбора в «Центре одарённости», который функционирует существующее в городе Ташкенте.
Инструкция по проведению этой методики в школах и средних специальных учебных заведениях заключается в следующем: «Вам предлагается 6 вопросов. Дайте справедливые ответы, сначала подумайте. Не показывайте ваши ответы другим. Заданные вопросы требует от вас выбрать 3 учеников из вашего класса. На первое место поставьте «самого лучшего», на второе «лучшего» и на третье «хорошего». Если вы не можете найти достойных ставьте минус (-). Если достойных больше 3 человек вы всё равно должны выбрать только 3 из них». Методист читает все вопросы по очереди и ученики записывают свои ответы. Вопросы следующие:
Если достойных больше 3 человек вы всё равно должны выбрать только 3 из них». Методист читает все вопросы по очереди и ученики записывают свои ответы. Вопросы следующие:
А. Кто в классе хорошо знает математику и физику? 1. 2. 3.
Б. Кто в классе хорошо знает биологию, химию или географию? 1. 2. 3.
В. Кто в классе много читает художественную или историческую литературу, хорошо и без ошибок пишет сочинения? 1. 2. 3.
Г. Кто в классе достиг успехов в сфере искусство, например, хорошо рисует, хорошо играет на музыкальных инструментах, имеет богатый эстетический вкус? 1. 2. 3.
Д. Выберите 3 учеников в классе, кто самый мудрый, начитанный и много работает над собой в изучении иностранных языков? 1. 2. 3.
2. 3.
Е. Когда имеются трудности по предметам, к кому вы обращаетесь за помощью в классе, то есть кто хорошо знает все предметы и хорошо объясняет? 1. 2. 3.
На проведение этой методики уходить максимум 10-15 минут. Собранные ответы анализируются следующим образом. Для каждого вопроса составляется отдельная матрица. В каждой матрице указываются фамилии учеников, которые упомянуты в ответах и записываются все оценки, поставленные в виде 1-место, 2-место или 3-место как в Таблице 1. Количество голосов обозначаются буквой «Н», сумма данных мест буквой « М». Если «М» разделить на «Н», то получаем коэффициент «К», который показывает среднее количество приоритета ученика в классе в сфере одарённости. Чем ближе «К» к 1, тем выше приоритет ученика. Каждая из 6 матриц заполняется таким образом. Далее в каждой матрице определяется ученики, набравшие больше 50 % голосов.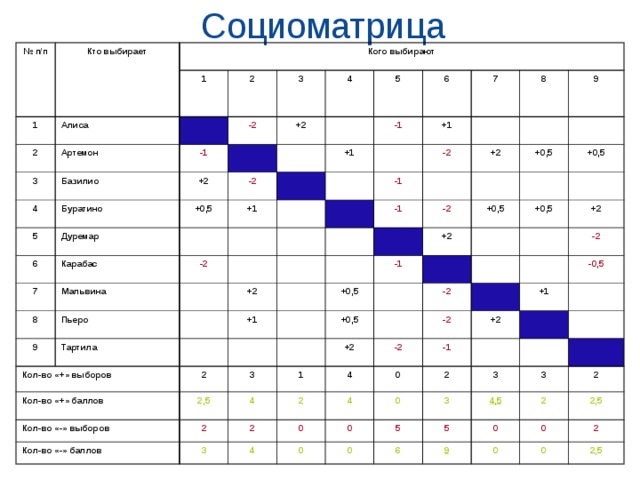 Если ученик набрал таких голосов в 3 и больше матрицах он проходит отбор. При большом количестве отобранных таким образом учеников, им также присваиваются места 1-е, 2-е и так далее. Мы изучили 9в-класс лицея города Ташкента.
Если ученик набрал таких голосов в 3 и больше матрицах он проходит отбор. При большом количестве отобранных таким образом учеников, им также присваиваются места 1-е, 2-е и так далее. Мы изучили 9в-класс лицея города Ташкента.
Таблица 1. Матрица А (Математика, физика).
| Фамилия | Показатели | Н | М | К | |
| 1 | Содикова Н | 111111111111111111 | 18 | 18 | 1 |
| 2 | Кобилова З | 2222222312 | 10 | 20 | 2 |
| 3 | Тухтаев Д | 3323 | 4 | 11 | 2,7 |
| 4 | Курбонов Б | 323 | 3 | 8 | 2,6 |
| 5 | Машарипов Д | 3332 | 4 | 11 | 2,7 |
| 6 | Кобилов Ш | 23332 | 5 | 13 | 2,6 |
Таблица 2. Матрица Б (Химия, биология, география).
Матрица Б (Химия, биология, география).
| Фамилия | Показатели | Н | М | К | |
| 1 | Содикова Н | 121121111111112 | 15 | 19 | 1,2 |
| 2 | Тухтаев Д | 222133323 | 9 | 21 | 2,3 |
| 3 | Курбонов Б | 31112 | 5 | 8 | 1,6 |
Таблица 3. Матрица В(Литература).
| Фамилия | Показатели | Н | М | К | |
| 1 | Саидахмедов Х | 11112223221221111 | 17 | 26 | 1,5 |
| 2 | Содикова Н | 2221111131112212 | 16 | 24 | 1,5 |
| 3 | Тухтаев Д | 3333 | 4 | 12 | 3 |
Таблица 4. Матрица Г(Искусство).
Матрица Г(Искусство).
| Фамилия | Показатели | Н | М | К | |
| 1 | Ахмедова Б | 1221321212311 | 13 | 17 | 1,3 |
| 2 | Камбарова Г | 12131321213 | 11 | 20 | 1,8 |
| 3 | Саидахмедов Х | 11221 | 5 | 7 | 1,4 |
| 4 | Каримов Д | 33121 | 5 | 10 | 2 |
| 5 | Содикова Н | 112 | 3 | 4 | 1,3 |
Таблица 5.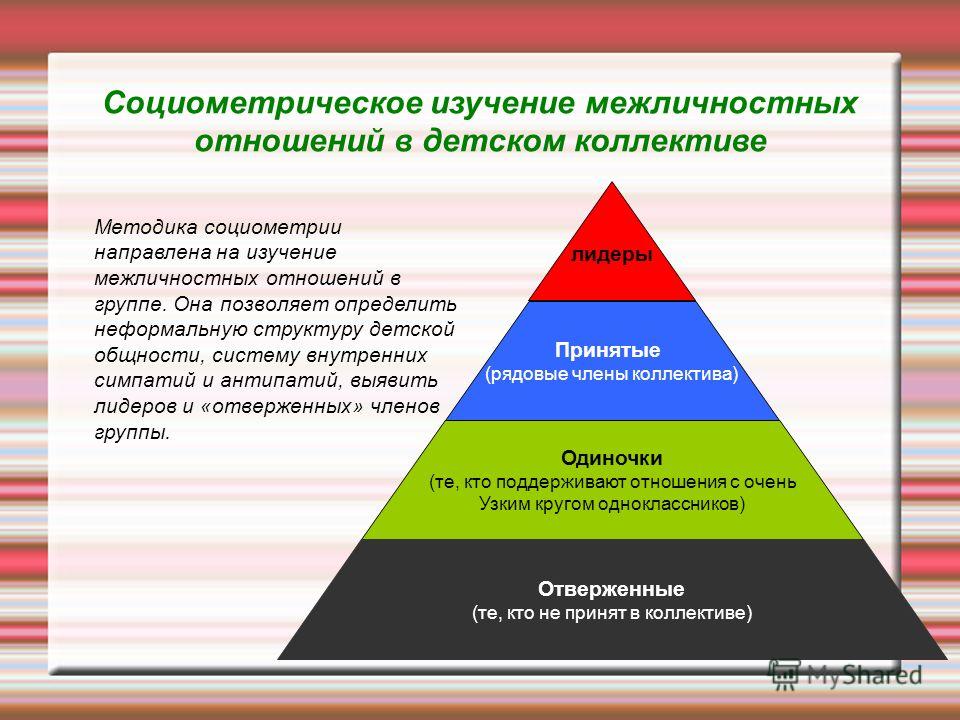 Матрица Д (Иностранные языки).
Матрица Д (Иностранные языки).
| Фамилия | Показатели | Н | М | К | |
| 1 | Содикова Н | 111111111111111211 | 18 | 19 | 1,05 |
| 2 | Куробонов Б | 23 | 2 | 5 | 2,5 |
| 3 | Эгамбердиев А | 32321232222223 | 14 | 31 | 2,2 |
Таблица 6. Матрица Е (Одарённость).
| Фамилия | Показатели | Н | М | К | |
| 1 | Содикова Н | 1111121111111121 | 16 | 18 | 1,1 |
| 2 | Кобилова З | 2222222312 | 8 | 17 | 2,1 |
| 3 | Рахимов А | 32 | 2 | 5 | 2,5 |
В результате, только Содикова Н была избрана как одарённая ученица, поскольку она получила высокие показатели голосов в пяти матрицах (А,Б,В,Д,Е), где в классе было 31 ученик. Далее была изучена корреляционная связь показателей «Социометрии интеллекта» с успеваемостью учеников, а именно 1-,2-,3-четвертными оценками. Мы остановились только на точных науках (алгебра, геометрия, информатика, физика). Корреляции между данными матрицы А по «Социометрии интеллекта» и четвертные оценки по алгебре, геометрии, информатике были положительными (Таблица 2). Как видно из Таблицы 2, корреляционная связь между социометрическими показателями и успеваемостью по математическим предметам высокая. Особенно она возрастает во 2-ой и 3-ей четверти, по сравнению с 1-четвертью.
Далее была изучена корреляционная связь показателей «Социометрии интеллекта» с успеваемостью учеников, а именно 1-,2-,3-четвертными оценками. Мы остановились только на точных науках (алгебра, геометрия, информатика, физика). Корреляции между данными матрицы А по «Социометрии интеллекта» и четвертные оценки по алгебре, геометрии, информатике были положительными (Таблица 2). Как видно из Таблицы 2, корреляционная связь между социометрическими показателями и успеваемостью по математическим предметам высокая. Особенно она возрастает во 2-ой и 3-ей четверти, по сравнению с 1-четвертью.
Таблица 7. Корреляция между матрицей А и четвертными оценками по предметам алгебра, геометрия, информатика и физика.
| Социометрия, матрица А | ||||
| Н | М | К | Четвертные оценки | |
| 513 | 489 | -328 | Алгебра, 1-четверть | |
| 615 | 620 | -243 | Алгебра, 2-четверть | |
| 586 | 534 | -180 | Алгебра, 3-четверть | |
| 437 | 387 | -319 | Геометрия, 1-четверть | |
| 648 | 633 | -359 | Геометрия, 2-четверть | |
| 519 | 404 | -395 | Геометрия, 3-четверть | |
| 504 | 512 | -290 | Информатика, 1-четверть | |
| 631 | 612 | -298 | Информатика, 2-четверть | |
| 533 | 421 | -427 | Информатика, 3-четверть | |
| 200 | 214 | -211 | Физика, 1-четверть | |
| 305 | 341 | -146 | Физика, 2-четверть | |
| 507 | 478 | -129 | Физика, 3-четверть | |
Преимущество методики «Социометрия интеллекта» состоит в том, что ученика оценивают все одноклассники в классе, и этим добивается объективность, справедливость оценок. И все же, не смотря на то, что «Социометрия интеллекта» выявляет склонности и способности учеников, это методика имеет и недостатки. На наш взгляд, оценка одарённости учеников одноклассниками ограничивается в пределах класса. Оценка производится в сравнении с другими учениками, которые учатся только в этом классе. А в классе могут учиться ученики даже с максимальным интеллектом, который не превышает среднего коэффициента. Поэтому эта методика самостоятельно, т. е. не проходя следующие этапы отбора одарённости, не может быть достоверной на 100%.
И все же, не смотря на то, что «Социометрия интеллекта» выявляет склонности и способности учеников, это методика имеет и недостатки. На наш взгляд, оценка одарённости учеников одноклассниками ограничивается в пределах класса. Оценка производится в сравнении с другими учениками, которые учатся только в этом классе. А в классе могут учиться ученики даже с максимальным интеллектом, который не превышает среднего коэффициента. Поэтому эта методика самостоятельно, т. е. не проходя следующие этапы отбора одарённости, не может быть достоверной на 100%.
Библиографический список
- Романова Е.С. 99 популярных профессий. Психологический анализ и профессиограммы. 2-е изд. СПб.: Питер, 2003. —464 с.
- Морено Д. Социометрия: пер. с англ// М.: Инлит.-1958.
- Б.Р.Кадыров «Изучение склонностей подростков», 1996.
Все статьи автора «sanobar»
404 Страница не найдена | Университет Ешива
Сообщение от нашего президента
Уважаемые студенты, преподаватели, сотрудники и друзья,
Я рад представить вам это Руководство по нашим планам на предстоящий осенний семестр и открытие наших кампусов. По форме и по содержанию предстоящий семестр будет не похож ни на один другой. Мы будем жить по-другому, работать по-другому и учиться по-другому. Но в самом его отличии кроется его огромная сила.
По форме и по содержанию предстоящий семестр будет не похож ни на один другой. Мы будем жить по-другому, работать по-другому и учиться по-другому. Но в самом его отличии кроется его огромная сила.
Миссия Университета Ешивы состоит в том, чтобы обогащать нравственное, интеллектуальное и духовное развитие каждого из наших студентов, наделяя их знаниями и способностями, чтобы они могли стать влиятельными людьми и лидерами завтрашнего дня. Учеба в следующем году будет особенно важной в формировании образа жизни наших студентов. Характер формируется и развивается во времена глубоких невзгод. Именно для такого обучающего момента и был создан университет ешива. Поэтому мы разработали образовательный план на следующий год, который включает в себя высококачественный студенческий опыт и ставит во главу угла личностный рост в эпоху коронавируса. Наши студенты смогут преодолеть трудности, проблемы и возможности, связанные с нашим COVID-19.эпохи с нашими звездными раввинами и преподавателями, а также их близкими друзьями и сверстниками в ешиве.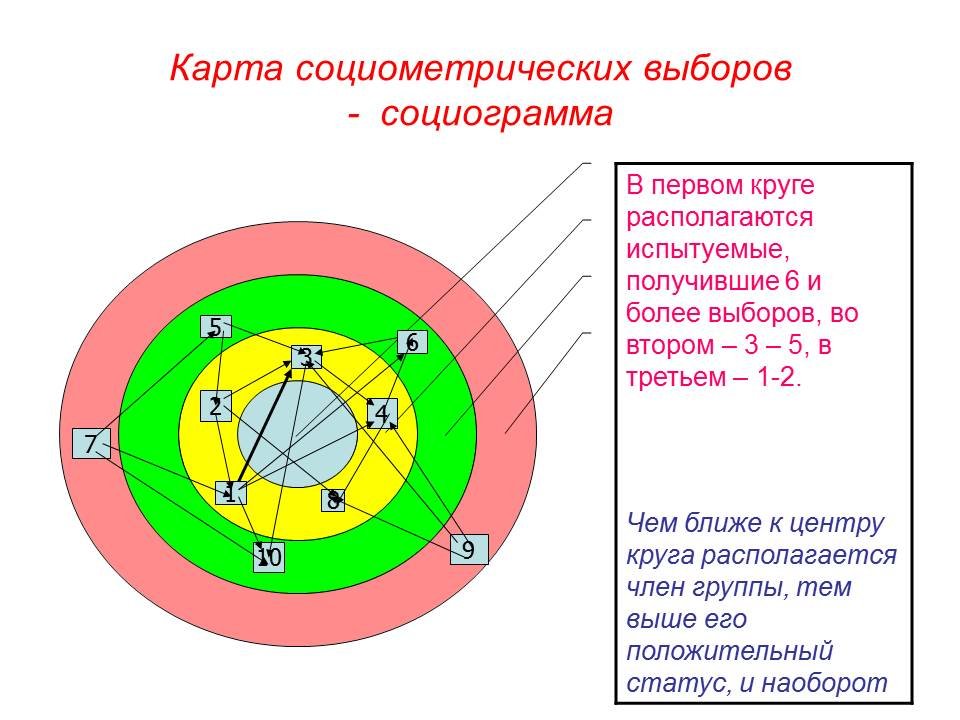
Чтобы разработать наши планы на осень, мы созвали Целевую группу по планированию сценариев, состоящую из представителей основных районов нашего кампуса. Их планирование основывалось на последней медицинской информации, правительственных директивах, непосредственном участии наших раввинов, преподавателей и студентов, а также на передовом опыте лидеров отрасли и университетов по всей стране. Я глубоко благодарен членам нашей целевой группы и всем, кто их поддерживал, за их неустанную работу по рассмотрению множества деталей, связанных с возвращением студентов в кампус и перезапуском нашего образовательного предприятия.
В соответствии с рекомендациями нашей целевой группы я объявляю сегодня, что наш осенний семестр будет отражать гибридную модель. Это позволит многим учащимся вернуться в школу, объединив онлайн- и виртуальное обучение с обучением в классе на территории кампуса. Это также позволяет студентам, которые предпочитают не находиться в кампусе, получить богатый студенческий опыт, продолжая обучение в Интернете и пользуясь полным спектром онлайн-услуг для студентов и внеклассных программ.
При возвращении наших студентов в кампус безопасность является нашим главным приоритетом. Многие аспекты жизни кампуса изменятся в этом семестре. Собрания будут ограничены, крупные курсы полностью перейдут в онлайн. В кампусе каждый должен будет соблюдать наши медицинские рекомендации, включая социальное дистанцирование, ношение масок, а также наши правила тестирования и отслеживания контактов. Из-за того, что мы стремимся свести к минимуму риск, наши студенты бакалавриата начнут первые несколько недель осеннего семестра онлайн и переедут в кампус после еврейских праздников. Этот график ограничит количество поездок наших студентов туда и обратно, сосредоточив компонент осеннего семестра в кампусе на одном последовательном сегменте.
При планировании мы использовали аналогию с диммерным выключателем. Повторное открытие наших кампусов будет не простым бинарным элементом, вроде выключателя света, а скорее диммером, в котором у нас будет возможность изменять масштаб вперед и назад, чтобы должным образом реагировать по мере развития ситуации со здоровьем. Вполне возможно, что некоторые планы могут измениться в зависимости от распространения вируса и/или применимых указаний государственных и местных органов власти.
Вполне возможно, что некоторые планы могут измениться в зависимости от распространения вируса и/или применимых указаний государственных и местных органов власти.
Перед началом нашего семестра мы предоставим больше обновлений, отражающих наши самые последние рекомендации. Пожалуйста, следите за обновлениями на нашем веб-сайте yu.edu/fall2020. Мы понимаем, что даже после прочтения этого руководства у вас может возникнуть много дополнительных вопросов, поэтому мы также разместим в Интернете обширный раздел часто задаваемых вопросов. Кроме того, в течение следующих нескольких месяцев мы также будем проводить общественные звонки для преподавателей, студентов, сотрудников и родителей.
Планирование будущего в этот момент определенно было унизительным. Этот коронавирус снова и снова напоминает нам об уроках нашей еврейской традиции о том, что мы не полностью контролируем свои обстоятельства. Но наша традиция также учит нас тому, что мы контролируем свою реакцию на обстоятельства. В следующем семестре вас ждут серьезные проблемы и изменения. Будут некоторые компромиссы и мелкие неудобства — не у каждой проблемы есть идеальное решение. Но вера и сила духа, взаимное сотрудничество и стойкость являются важными жизненными уроками, которые особенно важны в этот период. И если мы все обязуемся ответить милосердием, добротой и любовью, мы сможем превратить новые реалии кампуса в важные жизненные уроки для нашего будущего.
В следующем семестре вас ждут серьезные проблемы и изменения. Будут некоторые компромиссы и мелкие неудобства — не у каждой проблемы есть идеальное решение. Но вера и сила духа, взаимное сотрудничество и стойкость являются важными жизненными уроками, которые особенно важны в этот период. И если мы все обязуемся ответить милосердием, добротой и любовью, мы сможем превратить новые реалии кампуса в важные жизненные уроки для нашего будущего.
Глубоко укорененные в наших еврейских ценностях и нацеленные на подготовку к будущей карьере и компетенциям, мы путешествуем вместе с вами, нашим университетским сообществом ешивы, через эти неизведанные воды. Следующий год станет годом становления в жизни наших учеников, и вместе мы добьемся успеха, чтобы наши ученики стали сильнее и лучше подготовлены к тому, чтобы стать лидерами в мире завтрашнего дня.
С наилучшими пожеланиями,
Ари Берман
Больше не показывать
Перейти к основному содержанию
Перейти к настольной навигации, чтобы обойти мобильную навигацию
Главная Перейти к основной навигации, чтобы обойти вспомогательную навигациюЕшива Университет
место до
Поиск
Основная навигация
Страница, которую вы искали, не существует на этом веб-сайте. Пожалуйста, попробуйте найти его вместо этого.
Пожалуйста, попробуйте найти его вместо этого.
Что такое стехиометрия? Балансирующие уравнения, стехиометрические коэффициенты и задачи
Химическая стехиометрия относится к количественному изучению реагентов и продуктов, участвующих в химической реакции. Слово «стехиометрия» происходит от греческого слова «стойхейн», означающего элемент, и «метрон», означающего меру.
Термин «стехиометрия» был впервые введен или открыт немецким химиком по имени Иеремия Рихтер. Несмотря на то, что это словосочетание может показаться сложным и громоздким, на самом деле это простая идея. В этом уроке мы узнаем о том, что это значит, и обсудим различные аспекты этого понятия.
Что такое стехиометрия?
Простыми словами мы можем определить,
Стехиометрия как расчет продуктов и реагентов в химической реакции. В основном это связано с числами.
Стехиометрия — важное понятие в химии, которое помогает нам использовать сбалансированные химические уравнения для расчета количества реагентов и продуктов. Здесь мы используем соотношения из сбалансированного уравнения. В общем, все протекающие реакции зависят от одного главного фактора — количества присутствующего вещества.
Здесь мы используем соотношения из сбалансированного уравнения. В общем, все протекающие реакции зависят от одного главного фактора — количества присутствующего вещества.
Рекомендуемые видео
Стехиометрия помогает нам определить, сколько вещества необходимо или присутствует. Вещи, которые можно измерить;
- Масса реагентов и продуктов
- Молекулярная масса
- Химические уравнения
- Формулы
Стехиометрический коэффициент
Стехиометрический коэффициент или стехиометрическое число – это количество молекул, участвующих в реакции. Если вы посмотрите на любую сбалансированную реакцию, вы заметите, что в обеих частях уравнения содержится одинаковое количество элементов. Стехиометрический коэффициент — это в основном число, присутствующее перед атомами, молекулами или ионами.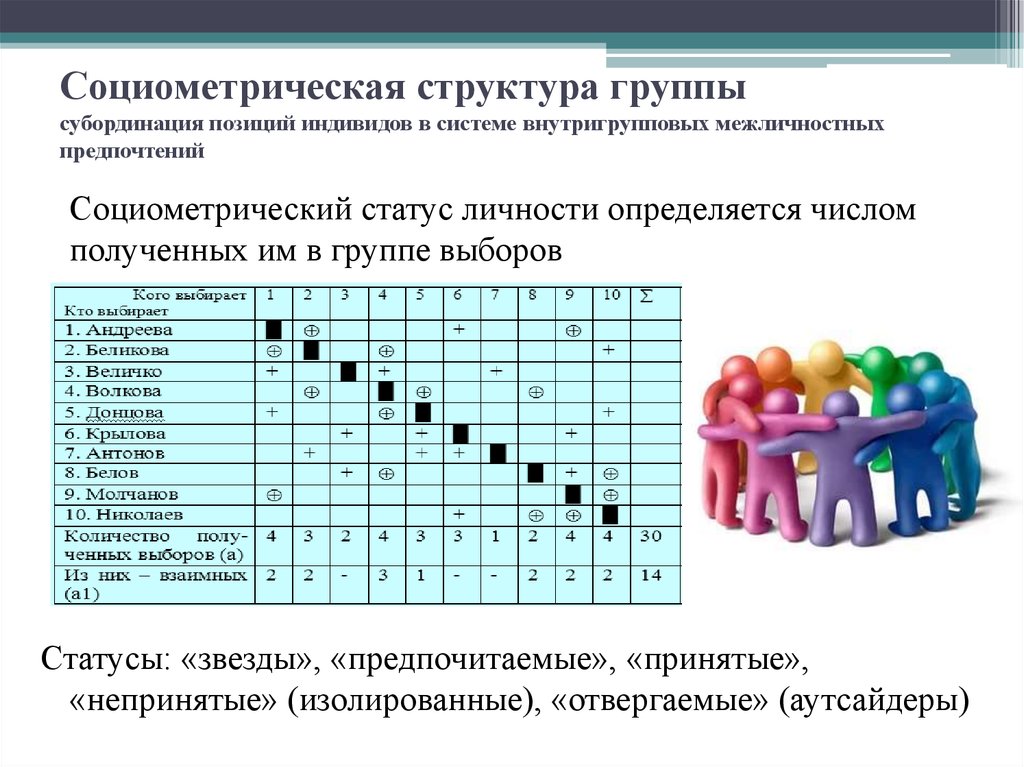
Стехиометрические коэффициенты могут быть как дробными, так и целыми числами. По сути, коэффициенты помогают нам установить молярное соотношение между реагентами и продуктами.
Сбалансированные реакции и молярные соотношения
Атомы и молекулы чрезвычайно малы по размеру и их количество в очень небольшом количестве вещества очень велико. Поэтому для представления атомов и молекул в объеме было введено понятие моль. В одном моле любого вещества содержится 6,022 х 10 23 номера этого вещества. Это число также известно как число Авогадро.
Масса одного моля вещества в граммах называется молярной массой. Молярная масса одного моля вещества численно равна массе атомной/молекулярной формулы.
Возьмем один пример сбалансированного химического уравнения.
3Fe(т) + 4H 2 O(л) ⇾ Fe 3 O 4 (т)+ 4h3 (г)
Количественная информация, полученная из этого сбалансированного химического уравнения, равна
- 3 моля Fe реагирует с 4 молями H 2 O с образованием одного моля Fe 3 O 4 и 4 молей H 2 .
- 168 г (56×3) Fe реагирует с 72 г (18×4) H 2 0 с образованием 231 г Fe 3 O 4 и 8 г газа H 2 .
Если реагенты и продукты находятся в газообразной форме, то учитывается молярный объем. Один моль любого газа занимает 22,4 литра.
CH 4 (г) + 2O 2 (г)⇾ CO 2 (г)+ 2H 2 0 (г)
В приведенной выше реакции 22,4 л CH 4 взаимодействует с 44,8 (2 x 22,4) л 0 2 с образованием 22,4 л CO 2 и 44,8 л H 2 O
Ограничивающий реагент
В химической реакции возможно, что один из реагентов присутствует в избыточном количестве. Следовательно, некоторые из этих избыточных реагентов останутся, когда реакция завершится; реакция останавливается сразу же, как только один из реагентов полностью израсходован.
Вещество, которое полностью расходуется в реакции, называется лимитирующим реагентом.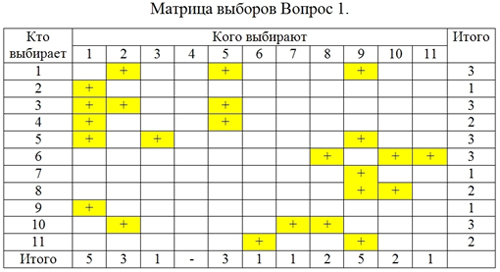
Давайте возьмем один пример химической реакции, чтобы понять концепцию ограничивающего реагента.
N 2 + 3H 2 ➝ 2NH 3
Предположим, у нас есть один моль N 2 , реагирующий с одним молем H 2 . Но из сбалансированного химического уравнения на один моль N 2 требуется три моля H 2 . Итак, лимитирующим реагентом в этой реакции является H 2 .
Стехиометрия в химическом анализе
Стехиометрические расчеты, основанные на методологии количественного анализа, часто используются химиками для определения концентраций веществ, присутствующих в образце. Есть в основном два основных типа анализа. Мы обсудим их ниже.
1. Гравиметрический анализ
В аналитической химии гравиметрический анализ описывает количественное определение аналита на основе массы твердого вещества. Гравиметрический анализ дает наиболее точные результаты из всех других аналитических анализов, поскольку вес вещества может быть измерен с большей точностью по сравнению с другими фундаментальными величинами.
Гравиметрический анализ можно разделить на следующие типы.
- Гравиметрия осаждения – Включает выделение иона из раствора с помощью реакции осаждения, фильтрацию, промывку осадка от загрязнений и, наконец, взвешивание осадка и определение его массы по разнице.
- Гравиметрия летучести – Гравиметрия летучести включает разделение компонентов смеси путем нагревания или химического разложения пробы.
- Электрогравиметрия – Включает электрохимическое восстановление ионов металлов на катоде и одновременное осаждение ионов на катоде. Катод взвешивают до и после электролиза, и разница в весе соответствует массе анализируемого вещества, изначально присутствующей в образце.
2. Объемный анализ
Объемный анализ включает количественное измерение вещества в единицах объема.
Принцип: в объемном анализе известный объем (V 1 ) вещества, концентрация которого (N 1 ) известна, вступает в реакцию с неизвестным объемом (V 2 ) раствора вещества, концентрацию которого (N 2 ) необходимо рассчитать. Объем V 1 отмечают в конце реакции. Концентрация N 2 рассчитывается по следующему уравнению.
Объем V 1 отмечают в конце реакции. Концентрация N 2 рассчитывается по следующему уравнению.
N 1 x V 1 = N 2 x V 2
На конечную точку такой реакции указывает изменение цвета или преципитация и т. д.
Термины, связанные с объемным анализом;
- Титрование – Процесс определения объема раствора, необходимого для полной реакции с объемом другого раствора, называется титрованием.
- Титрант – Раствор известной концентрации называется титрантом.
- Титрование – Раствор, концентрацию которого необходимо оценить.
- Индикатор – Индикаторы – это реагенты, которые меняют свой цвет после завершения реакции.
Стехиометрия и ее приложения – видеоурок
Стехиометрические задачи с решениями
1. Рассчитайте массу гидроксида натрия, необходимую для приготовления 500 мл 0,10 М раствора.
Решение:
Молярная масса NaOH = 40 г
Объем NaOH= 500 мл = 0,5 л
Молярность = 0,10 М
Молярность = моли/объем в литрах
⇒ масса NaOH = молярность x молярная масса NaOH x объем
= 0,10 х 40 х 0,5
= 2 г
2. Какой объем 11 М HCl нужно разбавить водой, чтобы приготовить 3 М 400 мл HCl?
Решение:
М1 = 11М
М2 = 3М
В 1 = ?
В 2 = 400 мл
Сейчас, M 1 x V 1 = M 2 x V 2
⇒ V 1 = (3×400)/11
= 109 мл
3. Сколько атомов углерода содержится в 0,5 молях щавелевой кислоты (C 2 Н 2 О 4 )?
Решение:
1 моль щавелевой кислоты = 6,022 х 10 23 число щавелевой кислоты
0,5 моль щавелевой кислоты = 6,022 х 10 23 х 0,5 число щавелевой кислоты
Поскольку на щавелевую кислоту приходится 2 атома углерода,
Следовательно, число атомов углерода в 0,5 моля щавелевой кислоты = 6,022 х 10 23 х 0,5 х 2
= 6,022 х 10 23
4.
