Паразитарное ложе твоего разума
Насколько мы руководствуемся собственными предпочтениями в принятии решений? На данный момент существует множество теорий, так или иначе объясняющих воздействие различных факторов на выбор, который мы делаем, однако рассмотрим ту, которая кажется наименее очевидной. Настолько, что не видна невооруженным глазом. В данном случае вместо «насколько мы свободны в принятии решений?» следует спросить: «насколько мы одиноки в принятии собственных решений?». Воздействия микроскопических сожителей зачастую кажутся нам незаметными, но отсутствие стандартных симптомов заболевания вовсе не делает вас свободным от нитей кукловодов из микромира. Их цель — выжить, источник их выживания — вы. Их пищевые привычки станут вашими привычками, их инстинкт размножения станет вашей необходимостью социального взаимодействия.
Но для начала давайте немного отойдем от человека (столь сложной модели) и обратимся к более простым в контексте неврологического развития примерам. Начнем с тех, без кого не обходится ни один летний денек.
Начнем с тех, без кого не обходится ни один летний денек.
Наиболее простой классификацией воздействия паразита на поведение хозяина будет следующая: паразитизм внутри мозга, внутри тела, вне тела и на расстоянии.
Те ужасы, которые мы видели в кинофильмах, для некоторых насекомых — печальная участь.
На данный момент, благодаря игре «The last of us», наиболее известным паразитом среди муравьев является гриб рода кордицепс. Споры гриба, попадая на кутикулы муравья, прикрепляются к ним, прорастая и проникая в тело муравья, распространяясь через трахею. Затем грибковые филаменты, называющиеся мицелием, растут, поедая органы хозяина, за исключением жизненно важных. Высвобождая определенные вещества, они влияют на навигацию муравья, обусловливая, к примеру, его стремление подняться повыше на дерево, закрепившись там. Если гриб готов к формированию спор, он сжирает мозг хозяина, прекращая страдания насекомого. Плодовые тела гриба затем прорастают кутикулу и освобождаются от капсулы, начиненной спорами. Капсула, подхваченная ветром, разрывается, распространяя споры, которые, попадая на кутикулы муравьев, повторяют цикл (рис. 1).
Капсула, подхваченная ветром, разрывается, распространяя споры, которые, попадая на кутикулы муравьев, повторяют цикл (рис. 1).
.
Рисунок 1 | Примеры из жизни куда менее устрашающие, учитывая тот факт, что на человека они не распространяются
Немного интереснее обстоят дела с мигрирующей от тела к мозгу муравья ланцетовидной двуусткой (Dicrocoelium dendriticum). Попадая в гемолимфу муравья из пищеварительного тракта, двуустки дрейфуют в организме хозяина некоторое время. Один из паразитов проникает к мозговому ганглию муравья, секретируя субстанции, влияющие на навигацию хозяина. Как только наступает вечер и снижается температура воздуха, муравей покидает колонию и забирается вверх по травинке. Там он закрепляется и ожидает, пока траву вместе с муравьем употребит пастбищное животное. Если этого не происходит, с наступлением утра и повышением температуры окружающего воздуха поведение муравья приходит в норму и он возвращается к обычной деятельности. Вечером все повторяется (рис. 2).
Вечером все повторяется (рис. 2).
.
Рисунок 2 | Слева направо: муравей закрепился на травинке; месторасположение ланцетовидной двуустки в организме муравья [1]
Еще более интересный случай наблюдается при паразитизме внутри социальной группы другого вида. Так, паразитом выступает гусеница (Maculinea rebeli), которая маскируется под муравьев (Myrmica schencki), выделяя определенные соединения и издавая звуки, которые муравьи используют для общения. Таким образом гусеница проникает в муравьиную колонию, где лакомится личинками муравьев. Но карма беспощадна: иронично, что эта гусеница является хозяином для паразитирующей осы (Ichneumon eumerus). Оса находит колонии муравьев и секретирует особые вещества, которые заставляют муравьев вести себя агрессивно. Воспользовавшись суматохой, оса находит гусеницу, жалит и внедряет в ее тело свои яйца (рис. 3).
.
Рисунок 3 | Слева направо: гусеница Maculinea rebeli, маскируясь, словно шпион, проникает в стан муравьев, однако терпит крах от другого агента — паразитирующей осы Ichneumon eumerus [2]
Интересным, возможно, покажется пример паразитизма между эусоциальными бумажными осами (Polistes dominula) и эндопаразитом (Xenos vesparum). Личинка выжидает свою жертву, а затем нападает на нее, проникая под кутикулу и внедряясь в брюшко осы (рис. 4). Внедрение паразита имеет долгоиграющие последствия для всей колонии.
Личинка выжидает свою жертву, а затем нападает на нее, проникая под кутикулу и внедряясь в брюшко осы (рис. 4). Внедрение паразита имеет долгоиграющие последствия для всей колонии.
Являясь эусоциальными насекомыми, бумажные осы формируют высокоорганизованные колонии со строгим делением на две касты: способные к репродукции и неспособные. Колонии состоят из одной или нескольких королев, которые строят гнездо и выводят потомство самок-рабочих (из касты нерепродуктивных). Как правило, представители одной касты не в состоянии демонстрировать поведенческие черты другой касты. Однако зараженные осы начинают вести себя неподобающим для социального насекомого образом. Так, рабочая оса демонстрирует поведение репродуктивной особи, покидая колонию для встречи с другими зараженными осами. Мужские и женские особи паразитоида спариваются. Если оса была инфицирована мужской особью, она умирает. Если женской, начинает вести себя как королева, питается и растет, пока не вернется в свою колонию, либо другую, распространяя паразитов дальше.
Данные РНК-секвенирования, используемые для характеристики паттернов экспрессии генов полового поведения в нейронах у инфицированных и неинфицированных самок ос демонстрируют экспрессию генов, отвечающих за репродуктивное поведение. Эти данные свидетельствуют о том, что паразитоид воздействует на своего хозяина, используя фенотипическую пластичность, связанную с социальной кастой, изменяя естественное социальное поведение так, что это выгодно паразитоиду.
.
Рисунок 4 | Слева направо: здоровая и зараженная Xenos vesparum особь
Для демонстрации внешней нейрорегуляции стоит привести пример взаимодействия между некоторыми гусеницами и муравьями: выделение гусеницей секрета с содержанием сахара активирует у муравьев систему вознаграждения. «Нектар» делает муравьев зависимыми и агрессивными, их деятельность со временем сводится к защите гусеницы и употреблению нектара (рис. 5). Мутуализм постепенно переходит в паразитизм, муравьи не в силах отказаться от нектара. У них выявляется повышенный уровень дофамина, в то время как другие моноамины в норме [3,4]. Как и в случае с попытками признать сахар наркотиком для человека, такие работы имели место быть, хотя они и достаточно спорны [5].
У них выявляется повышенный уровень дофамина, в то время как другие моноамины в норме [3,4]. Как и в случае с попытками признать сахар наркотиком для человека, такие работы имели место быть, хотя они и достаточно спорны [5].
.
Рисунок 5 | Гусеница Narathura japonica, окруженная муравьями, деятельность которых направлена на употребление нектара и защиту гусеницы от любых посягательств извне
В целом, существует куда больше примеров паразитизма. И суицидальное поведение сверчков при инвазии волосатиков, которые направляют их в воду, откуда затем волосатики вырываются в водное пространство, и яростная оборона гусеницей личинок осы во вред себе, и многое другое (рис. 6).
.
Рисунок 6 | Иллюстрации поведения насекомых, суицидальная наклонность которых обусловлена репродуктивной пользой для паразитических организмов
Вирусные заболевания также могут воздействовать на поведение хозяев. Так, бакуловирус контролирует поведение личинок чешуекрылых, заставляя их оставаться на открытой листве деревьев, подавляя линьку и окукливание, вызывая смерть и разложение, что способствует распространению вируса.
Некоторые другие вирусы могут потенцировать у своих хозяев агрессию, как, например, при заражении РНК-вирусом деформированного крыла медоносных пчел.
Агрессию у животных, в том числе человека, может вызывать вирус бешенства. Причиной данного явления считают нарушение деятельности никотиновых a2b4 рецепторов в ЦНС и снижение плотности серотонинергических рецепторов.
Несмотря на то что влияние этого вируса на поведение зараженного индивида существенно, основной целью данной статьи является рассмотрение возможности воздействия микроорганизмов на человека без выраженной симптоматики какого-либо заболевания.
Итак, приступим.
В принципе, любые микроорганизмы могут иметь необходимость влиять на пищевое поведения хозяина с целью удовлетворения собственных нужд. Но следует разделять влияние, опосредованное побочными механизмами энергозатрат и дефицита калорий, и влияние паразита непосредственно на ЦНС.
Инфекционное ожирение — это ожирение, обусловленное влиянием инфекционного агента.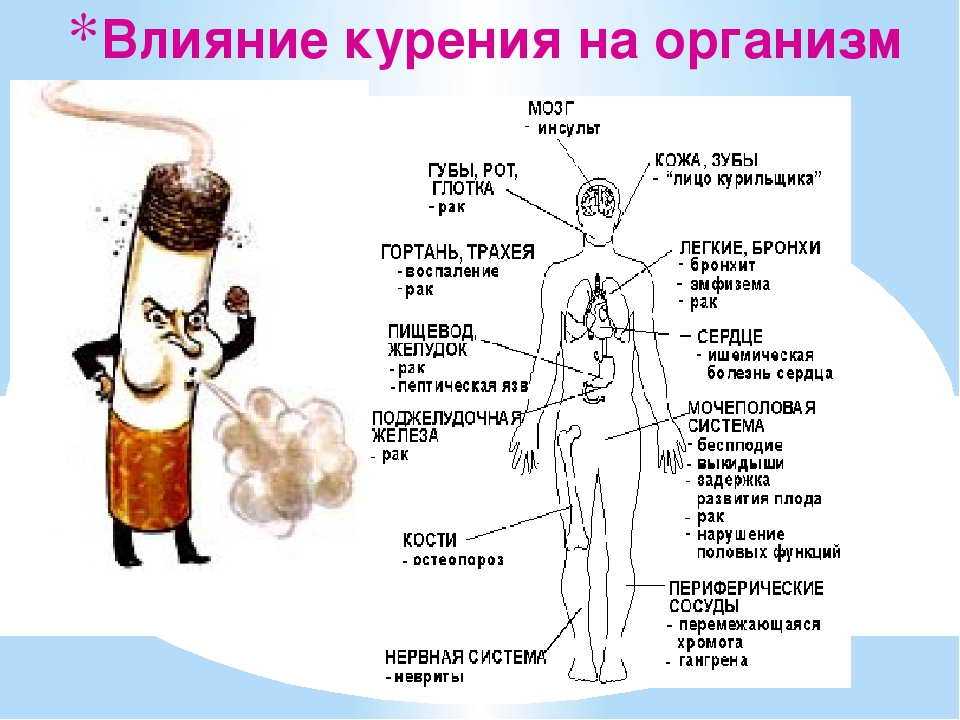 У человека чаще всего выявляют Аденовирус-36 (у детей — Аденовирус-5), реже обнаруживают ассоциации с ЦМВ-инфекцией или случаи серопозитивного носительства токсоплазмы [6].
У человека чаще всего выявляют Аденовирус-36 (у детей — Аденовирус-5), реже обнаруживают ассоциации с ЦМВ-инфекцией или случаи серопозитивного носительства токсоплазмы [6].
Основная причина развития ожирения при инфекции Аденовируса-36 закодирована в гене белка E4orfl, необходимого для репликации вируса, который приводит к активации дифференцировки преадипоцитов в адипоциты. Само собой, лица, серопозитивные по Аденовирусу-36, имеют больший шанс оказаться за гранью нормальной массы тела. Но здесь не все так просто. Лица с аденовирусным ожирением не имеют повышенного уровня холестерина и триглицеридов, свойственного людям с обычным ожирением. Ожирение при инфектоожирении — подкожное, а не абдоминальное. В чем причина?
Белок E4orfl в целях осуществления репликативной функции способствует активации GLUT-1-рецептора, деактивации IRS (insulin receptor substrate, субстрат инсулинового рецептора) и активации GLUT-4-рецептора через путь RAS-PI3K, таким образом предотвращая инсулинорезистентность. В основном глюкоза абсорбируется преадипоцитами, адипоцитами и миобластами. Снижение уровня холестерина и триглицеридов может быть обусловлено повышением уровня apoB и секрецией адипокинов жировыми клетками, инфицированными Аденовирусом-36. [7,8]
В основном глюкоза абсорбируется преадипоцитами, адипоцитами и миобластами. Снижение уровня холестерина и триглицеридов может быть обусловлено повышением уровня apoB и секрецией адипокинов жировыми клетками, инфицированными Аденовирусом-36. [7,8]
.
Рисунок 7 | Механизм профилактики инсулинорезистентности при инфицировании Аденовирусом-36 (Adv36)
Несмотря на эти положительные эффекты, инфекция остается хронической. Сниженное количество CD8+ и снижение/повышение количества CD4+ T-клеток приводит к нарушению элиминации возбудителя и поддержанию воспаления. Известно, что жировая ткань представляет собой не просто скопление жировых клеток, также в ее состав входит большое количество иммунных и соединительнотканных элементов. Аденовирус-36 способствует активации провоспалительных макрофагов М1. Также он активирует MCP-1 (макрофагальный хемоаттрактантный протеин-1), который опосредует инфильтрацию макрофагами адипоцитов и способствует секреции провоспалительных факторов и цитокинов. MCP-1 обусловливает ожирение, инсулинорезистентность и стеатоз. Миграция M1-макрофагов в жировую ткань поддерживает воспаление через активацию NF-kB (фактор транскрипции, вызывающий образование цитокинов и хемоаттрактантов, подавляющий апоптоз клеток), что приводит к прогрессированию ожирения.
MCP-1 обусловливает ожирение, инсулинорезистентность и стеатоз. Миграция M1-макрофагов в жировую ткань поддерживает воспаление через активацию NF-kB (фактор транскрипции, вызывающий образование цитокинов и хемоаттрактантов, подавляющий апоптоз клеток), что приводит к прогрессированию ожирения.
С увеличением количества жировой ткани увеличивается и количество лептина, который секретируют адипоциты. Лептин подавляет голод через активацию ПОМК-нейронов на аркуатном ядре, увеличивая секрецию альфа-меланоцитстимулирующего гормона (aМСГ), и активирует меланоцитстимулирующий рецептор-4 (MC-4R), оказывая анорексигенный эффект.
В случае Аденовирус-36-ассоциированного ожирения уровень лептина снижен, как и уровень норэпинефрина, что тоже может способствовать активации поведения, направленного на поиск пищи, через снижение активности парабрахиального ядра (рис. 8) [9] .
.
Рисунок 8 | Негативные проявления хронического персистирования в макроорганизме Аденовируса-36
Вирус Герпеса 1 типа и ЦМВ-инфекция действует похожим образом: длительное пребывание вирусов в адипоцитах способствует развитию воспаления, активации IFN каскада и подавлению выработки лептина [10].
Влиянию бактериофагов и микробиома кишечника на ЦНС посвящено множество исследований. Состояние микробиома отчасти влияет на развитие множества заболеваний, таких как депрессия, расстройства аутического спектра (РАС), тревожные расстройства, ожирение, функциональные гастроинтестинальные расстройства, синдром хронической усталости, воспалительные заболевания и т. д. [11] Продуктами метаболизма микробиоты являются нейромедиаторы и нейротропные факторы, способные воздействовать на ЦНС, что также подразумевает возможность микробиоты кишечника модулировать проницаемость интестинального барьера и ГЭБ. В некоторой степени воздействие на нейроэндокринную и нейроиммунную системы возможно через вагусную стимуляцию афферентных окончаний внутренностных нервов [12]. Здоровый биоценоз способствует сохранению когнитивных функций за счет поддержания постоянства концентрации BDNF (brain-derived neurotrophic factor, нейротрофический фактор мозга) в мозге, вероятно, путем передачи сигнала через афференты блуждающего нерва [13].
Учитывая наличие обратной связи, стрессорные факторы способны дестабилизировать микробиом и целостность интестинального барьера. Основной вклад в нарушение целостности интестинального барьера и развитие дисбиоза вносит КРГ (кортикотропин-рилизинг гормон) и его рецепторы — КРГР-1 и КРГР-2. Повышенная проницаемость кишечного барьера приводит к провоспалительному состоянию микробиоты, что в свою очередь ведет к высвобождению множества цитокинов, серотонина, MAMPs (микроб-ассоциированные молекулярные паттерны), активации TLR и последующего воспалительного каскада. Стоит отметить, что хотя серотонин и приводит к усилению локального воспаления и повышению проницаемости интестинального барьера, его концентрация значительно снижается ввиду перехода метаболизма триптофана на кинурениновый путь (рис. 9).
.
Рисунок 9 | Повышение проницаемости гематоинтестинального барьера и реализация провоспалительного каскада реакций, нарушение нормального функционирования связи кишечник-мозг
Микробиом кишечника различается в зависимости от пищевых привычек человека. К примеру, бактерии рода Prevotella лучше всего растут на углеводах, пищевые волокна обеспечивают рост и развитие Bifidobacteria, а Bacteroides предпочитают определенные жиры. Некоторые специализированные бактерии, например, муцин-деградирующие Akkermansia mucinophila, процветают на секретируемых клетками хозяина углеводах. Другие — бутират-продуцирующие микробы, такие как Roseburia spp, куда лучше растут при употреблении в пищу полисахаридных субстратов. Определенные микробы, переваривающие водоросли, были найдены только у лиц, проживающих в Японии. Африканские дети, питающиеся сорго, имеют уникальные бактерии, расщепляющие целлюлозу.
К примеру, бактерии рода Prevotella лучше всего растут на углеводах, пищевые волокна обеспечивают рост и развитие Bifidobacteria, а Bacteroides предпочитают определенные жиры. Некоторые специализированные бактерии, например, муцин-деградирующие Akkermansia mucinophila, процветают на секретируемых клетками хозяина углеводах. Другие — бутират-продуцирующие микробы, такие как Roseburia spp, куда лучше растут при употреблении в пищу полисахаридных субстратов. Определенные микробы, переваривающие водоросли, были найдены только у лиц, проживающих в Японии. Африканские дети, питающиеся сорго, имеют уникальные бактерии, расщепляющие целлюлозу.
Бактерии способны управлять пищевым поведением человека [14]. Это может быть обусловлено высвобождением нейромедиаторов и/или передачей сигнала по афферентам блуждающего нерва, что приводит к активации орексигенных центров. Стоит отметить, что отдельные исследования отмечают снижение массы тела в случае патологического ожирения при блокаде афферентных волокон n. vagus. Возможно, это как-то связано с моделированием сигнала от нарушенной микробиоты, при котором не формируется отвращения к еде. Кроме того, управление пищевым поведением обусловлено активацией системы вознаграждения через высвобождение продуктов метаболизма (дофамина и серотонина) определенными бактериями при употреблении определенного вида пищи (рис. 10).
vagus. Возможно, это как-то связано с моделированием сигнала от нарушенной микробиоты, при котором не формируется отвращения к еде. Кроме того, управление пищевым поведением обусловлено активацией системы вознаграждения через высвобождение продуктов метаболизма (дофамина и серотонина) определенными бактериями при употреблении определенного вида пищи (рис. 10).
Рисунок 10 | Механизмы воздействия микробиома кишечника на ЦНС
Следующий персонаж не подает внешних поводов для беспокойства. Угроза может быть пушистой и милой, либо лысой и несимпатичной (субъективное мнение автора). Сами того не ведая, они становятся распространителями паразитов, случайным образом забредших в организм человека.
Наверняка уже все понятно. Речь пойдет о токсоплазме.
Способность этого паразита специфически воздействовать на поведение хозяина, в том числе человека, привлекает внимание множества ученых и обывателей, следящих за научными открытиями.
Конечно, кроме токсоплазмы, другие латентные инфекции тоже способны воздействовать на поведение человека, повышать вероятность развития психических заболеваний, снижать когнитивные функции. Но наибольший интерес вызывает именно специфическое воздействие токсоплазмы гонди, формирующей полезное для себя поведение хозяина. А может, это вовсе не паразитизм, а нечто взаимовыгодное?
Я довольно негативно отозвался о кошках, ведь в принципе токсоплазма способна паразитировать на всех теплокровных животных в большей или меньшей степени. Однако именно кошки, поедая зараженных мышей, становятся постоянными хозяевами паразита, выделяя с фекалиями ооцисты, которые могут попасть в организм человека.
Токсоплазма способна вызывать у своего промежуточного хозяина повышенную двигательную активность, агрессивное поведение, уменьшение страха, а также формировать тропность крысы к запаху кошачьей мочи, тем самым увеличивая вероятность быть съеденной (чтобы паразит смог попасть в кишечник окончательного хозяина).
Удивительно и то, что механизмы, лежащие в основе такого поведения, повышают шансы зараженных самцов на спаривание. У крыс токсоплазмоз передается еще и половым путем. Общий механизм, ведущий как к снижению уровня страха, так и к росту привлекательности среди самок — повышенный уровень тестостерона.
Токсоплазма способствовала экспрессии рецепторов лютеинизирующего гормона на клетках Лейдига, приводя к повышению уровня тестостерона у крыс, но не у мышей, у которых, напротив, уровень тестостерона снижался относительно здоровых особей (рис. 11) [15].
В ЦНС у животных, в частности у крыс, токсоплазму обнаруживают в области миндалевидного тела. Эта структура ответственна за реакцию на стресс («бей или беги»), а также за запоминание стрессора. Паразит находится в астроцитах и нейронах, пораженные нейроны синтезируют большее, нежели у здоровых особей, количество дофамина [16]. Латентная инфекция приводит к нарушениям в работе цикла вознаграждения, стимулируя зараженного к поиску новых ощущений, увеличивая риск импульсивного поведения и суицида [17].
Рисунок 11 | Как видно из иллюстрации, цисты в головном мозге распределены случайно, высокая плотность часто отмечается в коре, гиппокампе, миндалине и дополнительной обонятельной луковице (ДОЛ). Гиппокамп ответственен за пространственное и контекстуальное обучение, миндалина — за формирование страха и тревоги, а ДОЛ участвует в обонянии
Хотя для токсоплазмы человек является тупиком (ибо домашнему коту все же трудно съесть человека), в случае с приматами дело обстоит иначе. Шимпанзе, у которых определяется носительство токсоплазмы, чаще, чем здоровые особи, попадают в пасть леопардам. Объясняется это тем же, чем и поведение крыс, зараженных токсоплазмой (они двигаются на запах мочи кошек). Поедая больных приматов, леопарды становятся постоянными хозяевами для токсоплазм [18].
Поскольку человеческий мозг достаточно сложен, некорректно воспринимать воздействие микроорганизмов на него как такую же манипуляцию в мире насекомых. Пищевое поведение может быть скорректировано силой воли, импульсивность и агрессивное поведение — сдержанностью, рационализацией, тщательным анализом ситуации. Однако вышеописанные микроорганизмы не вошли бы в список манипуляторов, если бы не изменяли поведение человек в свою пользу.
Однако вышеописанные микроорганизмы не вошли бы в список манипуляторов, если бы не изменяли поведение человек в свою пользу.
Стоит понимать, что для непосредственного управления поведением необходимо длительное взаимодействие определенного вида микроорганизма с определенным видом макроорганизма. Конечно, в долгосрочной перспективе токсоплазмоз, дисбаланс микрофлоры кишечника, латентная вирусная инфекция приводят к негативным последствиям, а врожденные состояния либо болезнь матери во время беременности повышают риск развития множества заболеваний (в т. ч. психических и неврологических) [19]. Однако достоверно неизвестно, могли ли во времена древнего человека, в краткосрочной перспективе проявиться признаки, ведущие к повышению выживаемости вида (как у некоторых млекопитающих, о которых мы говорили ранее).
Источники:
- https://www.londonntd.org/
- https://ferrebeekeeper.wordpress.com/
- David P. Hughes et al. Neuroparasitology of Parasite–Insect Associations //Annual Review of Entomology.
 — January 2018.
— January 2018. - Frederic Libersat, Maayan Kaiser, Stav Emanuel. Mind Control: How Parasites Manipulate Cognitive Functions in Their Insect Hosts // Frontiers in Psychology. — 2018.
- James J DiNicolantonio, James H O’Keefe, William L Wilson. Sugar addiction: is it real? A narrative review // British Journal of Sports Medicine. — 2018.
- Voss JD, Dhurandhar NV. Viral Infections and Obesity // Current obesity reports. — 2017.
- Dhurandhar EJ, Krishnapuram R, Hegde V, Dubuisson O, Tao R, Dong XC, Ye J, Dhurandhar NV. E4orf1 improves lipid and glucose metabolism in hepatocytes: a template to improve steatosis & hyperglycemia // PLoS One. — 2012
- Eleonora Ponterio and Lucio Gnessi. Adenovirus 36 and Obesity: An Overview // Viruses. — 2015.
- Wellman PJ. Norepinephrine and the control of food intake // Nutrition. — 2000.
- Yu L, Liu P, Liu Z, Zhu W, Yan K, Chen Q, Han D. p204-Mediated innate antiviral responses in mouse adipose cells and their effects on cell functions // Immunology and cell biology.
 — 2015.
— 2015. - Glenda MacQueen, Michael Surette and Paul Moayyedi. The gut microbiota and psychiatric illness // Journal of psychiatry & neuroscience. — 2017.
- Kelly, J. R., Kennedy, P. J., Cryan, J. F., Dinan, T. G., Clarke, G., & Hyland, N. P.. Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders // Frontiers in cellular neuroscience. -2015.
- Maqsood R, Stone TW. The Gut-Brain Axis, BDNF, NMDA and CNS Disorders // Neurochemical research. — 2016.
- Alcock, J., Maley, C. C., & Aktipis, C. A. Is eating behavior manipulated by the gastrointestinal microbiota? Evolutionary pressures and potential mechanisms // BioEssays : news and reviews in molecular, cellular and developmental biology — 2014.
- Ajai Vyas. Parasite-augmented mate choice and reduction in innate fear in rats infected by Toxoplasma gondii // Journal of Experimental Biology. — 2013.
- Ann-Kathrin Stock, Danica Dajkic, Hedda Luise Köhling, Evelyn Heintschel von Heinegg, Melanie Fiedler & Christian Beste.
 Humans with latent toxoplasmosis display altered reward modulation of cognitive control // Nature Scientific Reports. — 2017
Humans with latent toxoplasmosis display altered reward modulation of cognitive control // Nature Scientific Reports. — 2017 - Thomas B.Cook, et al. «Latent» infection with Toxoplasma gondii: Association with trait aggression and impulsivity in healthy adults // Journal of Psychiatric Research. —
2015. - Poirotte C, Kappeler PM, Ngoubangoye B, Bourgeois S, Moussodji M, Charpentier MJ. Morbid attraction to leopard urine in Toxoplasma-infected chimpanzees // Current Biology. — 2016.
- Hadar R, et al. Deep brain stimulation during early adolescence prevents microglial alterations in a model of maternal immune activation // Brain, behavior and immunity. — 2017.
Трематодозы пищевого происхождения
Трематодозы пищевого происхождения- Вопросы здравоохранения »
- A
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- Популярные темы
- Загрязнение воздуха
- Коронавирусная болезнь (COVID-19)
- Гепатит
- Данные и статистика »
- Информационный бюллетень
- Факты наглядно
- Публикации
- Найти страну »
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Ъ
- Ы
- Ь
- Э
- Ю
- Я
- ВОЗ в странах »
- Репортажи
- Регионы »
- Африка
- Америка
- Юго-Восточная Азия
- Европа
- Восточное Средиземноморье
- Западная часть Тихого океана
- Центр СМИ
- Пресс-релизы
- Заявления
- Сообщения для медиа
- Комментарии
- Репортажи
- Онлайновые вопросы и ответы
- События
- Фоторепортажи
- Case studies
- Вопросы и ответы
- Выступления
- Последние сведения
- Чрезвычайные ситуации »
- Новости »
- Новости о вспышках болезней
- Данные ВОЗ »
- Приборные панели »
- Приборная панель мониторинга COVID-19
- Основные моменты »
- Информация о ВОЗ »
- Генеральный директор
- Информация о ВОЗ
- Деятельность ВОЗ
- Где работает ВОЗ
- Руководящие органы »
- Всемирная ассамблея здравоохранения
- Исполнительный комитет
- Главная страница/
- Центр СМИ/
- Информационные бюллетени/
- Подробнее/
- Трематодозы пищевого происхождения
© Фото
Основные факты
- Ежегодно инвалидность и смертность в результате заболевания трематодозами пищевого происхождения приводит к утрате 2 миллионов лет жизни, скорректированных на инвалидность.

- Заражение человека происходит при употреблении сырой рыбы, ракообразных или растений, содержащих личинки паразита.
- Трематодозы пищевого происхождения наиболее распространены в Восточной Азии и Южной Америке.
- Они приводят к тяжелым заболеваниям печени и легких.
- Для профилактики и лечения трематодозов пищевого происхождения существуют безопасные и эффективные лекарства.
- Профилактика трематодозов пищевого происхождения и борьба с ними должна осуществляться на основе сотрудничества между различными секторами, работающими на рубеже взаимодействия между человеком, животными и экосистемами.
Трематодозы пищевого происхождения являются зоонозами, и их возбудители могут передаваться человеку только после завершения сложного жизненного цикла, некоторые стадии которого протекают в организме промежуточного животного хозяина.
Первыми промежуточными хозяевами всех видов трематод являются пресноводные улитки. Второй хозяин бывает разным в зависимости от вида: в случае клонорхоза и описторхоза это пресноводные рыбы, а в случае парагонимоза — ракообразные. Заражение возбудителем парагонимоза может также происходить в результате употребления в пищу животных, питающихся ракообразными, например сырого мяса дикого кабана. В случае фасциолеза второй промежуточный хозяин не требуется, и заражение человека может происходить при употреблении содержащих личинки пресноводных растений. Окончательными хозяевами паразита всегда являются млекопитающие (см. таблицу 1).
Второй хозяин бывает разным в зависимости от вида: в случае клонорхоза и описторхоза это пресноводные рыбы, а в случае парагонимоза — ракообразные. Заражение возбудителем парагонимоза может также происходить в результате употребления в пищу животных, питающихся ракообразными, например сырого мяса дикого кабана. В случае фасциолеза второй промежуточный хозяин не требуется, и заражение человека может происходить при употреблении содержащих личинки пресноводных растений. Окончательными хозяевами паразита всегда являются млекопитающие (см. таблицу 1).
Заражение человека происходит при употреблении в пищу инвазированного паразитом второго промежуточного хозяина или, в случае фасциолеза – водной растительности, к которой прикрепляется личинка паразита.
Клонорхоз и описторхоз в основном распространены в Азии, где многие страны являются эндемичными по данным заболеваниям. В ряде гиперэндемичных сельских населенных пунктов Лаосской Народно-Демократической Республики зарегистрирован уровень пораженности населения O. viverrini на уровне свыше 80%. Парагонимоз встречается в Африке, Азии и Латинской Америке, иногда в районах, одновременно эндемичных по туберкулезу и трематодозам, что часто приводит к неправильной диагностике и лечению болезни и способствует неполной регистрации случаев. Фасциолез распространен повсеместно и является проблемой для значительного числа стран мира, из которых наиболее высокое бремя заболевания регистрируется в Латинской Америке и на Ближнем Востоке. Хотя случаи заболевания трематодозами пищевого происхождения отмечаются в более чем 70 странах мира, данные об их фактической распространенности весьма ограничены; особенно острый дефицит эпидемиологических данных существует в странах Африки.
viverrini на уровне свыше 80%. Парагонимоз встречается в Африке, Азии и Латинской Америке, иногда в районах, одновременно эндемичных по туберкулезу и трематодозам, что часто приводит к неправильной диагностике и лечению болезни и способствует неполной регистрации случаев. Фасциолез распространен повсеместно и является проблемой для значительного числа стран мира, из которых наиболее высокое бремя заболевания регистрируется в Латинской Америке и на Ближнем Востоке. Хотя случаи заболевания трематодозами пищевого происхождения отмечаются в более чем 70 странах мира, данные об их фактической распространенности весьма ограничены; особенно острый дефицит эпидемиологических данных существует в странах Африки.
Внутри стран инвазии обычно происходят в границах определенных очагов и связаны с привычками населения и особенностями местных экосистем. Риск заражения может повышаться при неудовлетворительном состоянии санитарных систем и несоблюдении гигиены питания, ограниченной доступности безопасной питьевой воды и определенных культурно обусловленных пищевых предпочтениях населения. Традиции совместного принятия пищи могут способствовать возникновению кластеров заражения в семьях или среди знакомых.
Традиции совместного принятия пищи могут способствовать возникновению кластеров заражения в семьях или среди знакомых.
Истинные показатели бремени таких инвазий неясны, поскольку поражаемые ими группы населения зачастую мало о них знают и не всегда имеют возможность обращаться за медицинской помощью. В ходе расчетов, выполненных Справочной группой ВОЗ по эпидемиологии бремени болезней пищевого происхождения (2015 г.), было определено четыре вида передаваемых с пищей трематод, которые являются значимыми причинами инвалидности и, согласно оценкам, ежегодно вызывают в общей сложности 200 000 случаев болезни и более 7000 случаев смерти, приводя к утрате более 2 миллионов лет жизни, скорректированных по инвалидности, во всем мире.
Трематодозы пищевого происхождения также наносят значительный экономический ущерб животноводству и рыбоводству в результате снижения продуктивности животных, а также введения ограничений на экспорт продукции и сокращения потребительского спроса.
Таблица 1. Эпидемиологические характеристики трематодозов пищевого происхождения
Эпидемиологические характеристики трематодозов пищевого происхождения
| Болезнь | Возбудитель | Приобретается при потреблении | Естественные окончательные хозяева | |
| Клонорхоз | Clonorchis sinensis | пресноводной рыбы | собаки и другие питающиеся рыбой хищники | |
| Описторхоз | Opisthorchis viverrini, O. felineus | пресноводной рыбы | кошки и другие питающиеся рыбой хищники | |
| Фасциолез | Fasciola hepatica, F. gigantica | водных растений | овцы, крупный рогатый скот и другие травоядные | |
| Парагонимоз | Paragonimus spp. | пресноводных ракообразных (крабов и раков) | кошки, собаки и другие питающиеся рыбой хищники |
Бремя трематодозов пищевого происхождения для общественного здравоохранения выражается скорее в заболеваемости, нежели в смертности, при этом инвазии на ранних стадиях и в легкой форме часто остаются незамеченными. Хронические инвазии, как правило, сопровождаются тяжелой симптоматикой, затрагивающей конкретный орган, в котором локализуются взрослые особи гельминтов.
Хронические инвазии, как правило, сопровождаются тяжелой симптоматикой, затрагивающей конкретный орган, в котором локализуются взрослые особи гельминтов.
Легкая инвазия Opisthorchis spp и Clonorchis sinensis может протекать бессимптомно в острой фазе, однако при высокой паразитарной нагрузке вследствие обструкции желчных протоков гельминтами могут наблюдаться такие клинические проявления, как лихорадка и боль в верхнем правом отделе живота. Наиболее тяжело может протекать хроническая инвазия O. viverrini и C. sinensis, вызванная растянутыми во времени эпизодами повторного заражения, когда хроническое воспаление приводит к фиброзу желчных протоков и повреждению сопредельной печеночной паренхимы. Такие патологические изменения могут привести к развитию холангиокарциномы – тяжелой и нередко смертельной форме рака желчных протоков. По этой причине как O. viverrini, так и C. sinensis признаны канцерогенами. Имеющихся данных о хронических инвазиях O. felineus недостаточно для того, чтобы данный паразит был отнесен к канцерогенам.
felineus недостаточно для того, чтобы данный паразит был отнесен к канцерогенам.
Фасциолез протекает в виде бессимптомного острого периода после попадания паразита в организм, за которым следуют острый период и хроническая фаза заболевания. Острый период заражения фасциолами начинается при разрушении молодыми сосальщиками ткани стенок кишечника и брюшины и их внедрении через оболочку печени в желчные протоки. Этот процесс сопровождается разрушением клеток печени и приводит к внутреннему кровотечению. Симптомы могут включать в себя лихорадку, тошноту, увеличение печени, крапивницу и острую боль в животе. Хроническая фаза заболевания начинается, когда гельминты проникают в желчные протоки, достигают половозрелости и начинают откладывать яйца. Яйца попадают сначала в желчь, затем в кишечник и с калом выделяются во внешнюю среду. Это может проявляться такими симптомами, как периодическая боль, желтуха, анемия, панкреатит и желчекаменная болезнь. Вследствие хронического воспалительного поражения тканей хронические инвазии приводят к циррозу печени.
Парагонимоз на ранних стадиях может протекать бессимптомно. После проникновения паразита в легкие заболевание может сопровождаться выраженными клиническими проявлениями, в частности постоянным кашлем с выделением окрашенной кровью мокроты, болью в грудной клетке, одышкой и лихорадкой, которые могут приводить к таким осложнениям, как плевральный выпот и пневмоторакс. Симптомы и проявления заболевания можно спутать с туберкулезом, и это необходимо учитывать при отсутствии улучшений в процессе лечения больных с подозрением на туберкулез. Также довольно часто встречается эктопический парагонимоз, наиболее распространенной формой которого является церебральный парагонимоз. Его клиническими проявлениями могут быть головная боль, ухудшение зрения, эпилептические судороги и кровоизлияние в мозг.
ДиагностикаСлучаи с подозрением на трематодозы пищевого происхождения выявляются на основании анализа клинической картины, оценки пищевого анамнеза на предмет факторов риска (употребление в пищу сырой рыбы, ракообразных, не прошедших термическую обработку водных растений), наличия эозионофилии и характерных изменений, видимых при выполнении ультразвукового исследования, компьютерной томографии (КТ) или магниторезонансной томографии (МРТ). Для подтверждения диагноза применяются различные диагностические методы.
Для подтверждения диагноза применяются различные диагностические методы.
- Паразитологические методы обнаружения яиц в образцах кала при подозрении на клонорхоз, описторхоз и фасциолез и прямое микроскопическое исследование мазков мокроты при подозрении на парагонимоз. Эти методы применяются чаще всего и характеризуются низкой чувствительностью при легкой паразитарной нагрузке, но при соответствующей квалификации лаборанта позволяют получить точный результат, хотя дифференциация морфологических особенностей яиц паразита при этом может быть затруднена. Исследование методом мазка по Като-Кац рекомендуется проводить дважды.
- Иммунологические методы для выявления паразит-специфических антител в образцах сыворотки или паразит-специфических антигенов в образцах сыворотки или кала. Данные методы нередко оказываются более чувствительными, однако выявление антител не позволяет различать текущие, недавно перенесенные или прошлые инвазии. Также возможны перекрестные реакции с антигенами других трематод.

- Такие молекулярные методы, как метод полимеразной цепной реакции, могут оказаться полезными и в настоящее время находятся на этапе экспериментальной разработки.
Борьба с трематодозами пищевого происхождения направлена на снижение риска заражения и уменьшение связанной с этим заболеваемости. При этом следует применять всеобъемлющий подход к вопросам здоровья, позволяющий учитывать взаимосвязи между здоровьем животных и человека и состоянием окружающей среды. Для сокращения интенсивности и риска инвазий следует осуществлять комплекс мер, включающий информационно-разъяснительную и просветительскую работу среди населения по вопросам обеспечения безопасности пищевых продуктов, совершенствование санитарных систем и ведение санитарного и ветеринарного надзора.
В целях уменьшения заболеваемости ВОЗ рекомендует повышать доступность лечения с применением безопасных и эффективных противогельминтных средств.
- Лечение клонорхоза и описторхоза проводят празиквантелом дозами по 25 мг/кг три раза в день на протяжении двух–трех дней подряд либо однократной дозой 40 мг/кг.

- Лечение фасциолеза проводят однократной дозой триклабендазола 10 мг/кг. При отсутствии лечебного эффекта дозировку можно увеличить до 20 мг/кг в виде двух раздельных доз с интервалом 12–24 часа.
- Лечение парагонимоза может осуществляться триклабендазолом 20 мг/кг в виде двух раздельных доз по 10 мг/кг, назначаемых в один день, либо празиквантелом 25 мг/кг три раза в день на протяжении трех дней. Лечение триклабендазолом является предпочтительным в силу простоты данной схемы и, соответственно, более четкого соблюдения режима лечения.
В целях контроля за состоянием здоровья населения ВОЗ рекомендует проводить обследования населения на районном уровне и обеспечивать массовой химиопрофилактикой соответствующие группы населения в районах с большим количеством пораженных инвазиями лиц. Оказание индивидуальной помощи путем лечения пациентов с подтвержденной или подозреваемой инвазией является целесообразным в условиях меньшей концентрации случаев заболевания и доступности медицинских учреждений.
Распространенность инвазий не может быть снижена исключительно методами профилактической химиотерапии невозможно. Такие факторы, как антисанитария и несоблюдение гигиены питания, наличие животных резервуаров паразитов и традиционные пищевые привычки населения, могут повышать показатели повторного заражения среди населения после лечения. При этом программы массовой химиопрофилактики должны осуществляться в рамках более широкого подхода к охране здоровья, предполагающего санитарное просвещение населения, ветеринарный и фитосанитарный надзор, обеспечение безопасности пищевых продуктов и совершенствование систем водоснабжения, санитарии и гигиены.
Рекомендуемые схемы лечения и стратегии обобщенно представлены в таблице 2.
Таблица 2. Рекомендуемые схемы и стратегии лечения
| Болезнь | Рекомендуемый препарат и дозировка | Рекомендуемая стратегия | |
| Клонорхоз и описторхоз | Ведение отдельных случаев | ||
| Празиквантел: 25 мг/кг три раза в день в течение 2–3 дней подряд | — Лечение всех подтвержденных случаев — В эндемичных районах: лечение всех подозрительных случаев | ||
| Профилактическая химиотерапия | |||
| Празиквантел: 40 мг/кг однократно | — В районах, сельских населенных пунктах или общинах, где имеются признаки очагов групповой заболеваемости: лечение всех жителей каждые 12 месяцев | ||
| Фасциолез | Ведение отдельных случаев | ||
| Триклабендазол: 10 мг/кг однократно (в случае отсутствия лечебного эффекта возможна двойная доза 20 мл/кг в два раздельных приема с интервалом 12–24 часа) | — Лечение всех подтвержденных случаев — В эндемичных районах: лечение всех подозрительных случаев | ||
| Профилактическая химиотерапия | |||
| Триклабендазол: 10 мг/кг однократно | В районах, сельских населенных пунктах или общинах, где имеются признаки очагов групповой заболеваемости: лечение всех детей школьного возраста (5–14 лет) или всех жителей каждые 12 месяцев | ||
| Парагонимоз | Ведение отдельных случаев | ||
| Триклабендазол: 2 х 10 мг/кг в течение одного дня или празиквантел: 25 мг/кг три раза в день в течение трех дней | — Лечение всех подтвержденных случаев — В эндемичных районах: лечение всех подозрительных случаев | ||
| Профилактическая химиотерапия | |||
| Триклабендазол: 20 мг/кг однократно | В районах, сельских населенных пунктах или общинах, где имеются признаки очагов групповой заболеваемости: лечение всех жителей каждые 12 месяцев | ||
ВОЗ активно выступает за включение трематодозов пищевого происхождения в число заболеваний, подлежащих профилактической химиотерапии. В целях обеспечения доступа к качественным лекарственным препаратам ВОЗ согласовала порядок обеспечения эндемичных стран триклабендазолом для лечения фасциолеза и парагонимоза, а также празиквантелом для лечения клонорхоза и описторхоза. ВОЗ получает заявки от министерств здравоохранения, которые получают данные лекарственные средства бесплатно.
В целях обеспечения доступа к качественным лекарственным препаратам ВОЗ согласовала порядок обеспечения эндемичных стран триклабендазолом для лечения фасциолеза и парагонимоза, а также празиквантелом для лечения клонорхоза и описторхоза. ВОЗ получает заявки от министерств здравоохранения, которые получают данные лекарственные средства бесплатно.
Трематодозы пищевого происхождения характеризуются сложным зоонозным жизненным циклом и тесно связаны с ненадлежащим состоянием санитарных систем, несоблюдением правил гигиены питания и присутствием животных резервуаров в непосредственной близости от мест проживания людей. Решающее значение для борьбы с трематодными инвазиями пищевого происхождения имеет концепция «Единое здоровье», предусматривающая принятие комплексных мер в ветеринарном и сельскохозяйственном секторе, улучшение санитарных систем и повышение доступности безопасной воды, а также ведение разъяснительной работы о необходимости более строгого обеспечения безопасности продуктов питания и соблюдения правил гигиены.
Для укрепления междисциплинарного сотрудничество ВОЗ осуществляет тесное взаимодействие с такими партнерскими учреждениями, как Всемирная организация по охране здоровья животных (МЭБ) и Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО). В целях активизации мер с участием различных секторов и коллективного содействия странам в укреплении потенциала для эффективной борьбы с паразитарными заболеваниями пищевого происхождения организуются совместные трехсторонние совещания, примером которых является проведенное в Лаосской Народно-Демократической Республике в 2018 г. совещание по ускорению профилактики и сдерживания забытых паразитарных зоонозов пищевого происхождения в азиатских странах. Кроме того, в рамках трехстороннего сотрудничества подготовлена и опубликована серия информационных и рекомендательных документов, предназначенных для представителей различных секторов, а именно специалистов общественного здравоохранения, органов по контролю за безопасностью пищевых продуктов и ветеринарных врачей.
Эффективное межсекторальное сотрудничество в рамках сети по ЗТБ повышает качество и экономическую эффективность мероприятий и сводит к минимуму дублирование работы. Трематодозы пищевого происхождения нередко сосуществуют со многими другими эндемическими заболеваниями, в частности поражающими уязвимые группы населения.
ВОЗ содействует интеграции мероприятий по эпиднадзору за трематодозами пищевого происхождения в состав программ по ВСГ и другим связанным с ВСГ заболеваниям, а также совместному проведению профилактической химиотерапии среди затронутого ими групп населения наряду с соответствующими программами поставки продовольствия и проведения иммунизации. Параллельное выявление парагонимоза и туберкулеза может повысить эффективность эпиднадзора и обеспечить точную диагностику этих заболеваний и лечение пациентов.
Как диета с высоким содержанием жиров способствует изгнанию кишечных паразитов — ScienceDaily
Ученые обнаружили, что диета с высоким содержанием жиров позволяет иммунной системе уничтожать паразитических червей, которые являются основной причиной смерти и болезней в развивающихся странах.
Паразитические черви поражают до миллиарда человек, особенно в развивающихся странах с плохими санитарными условиями. Один из этих паразитов, известный как «власоглав», может вызывать длительные инфекции в толстой кишке.
Исследователи из Ланкастерского университета и Манчестерского университета в Великобритании обнаружили, что диета с высоким содержанием жиров позволяет иммунной системе уничтожать паразита.
Ведущий автор, доктор Эвелин Фуджика, ранее работавшая в Манчестере, а теперь работающая в Университете Замбии, сказала: «Как и в Великобритании, самые дешевые диеты часто содержат много жира, и сообщества, подверженные риску заражения власоглавом, все чаще используют эти дешевые диеты. Поэтому , то, как взаимодействуют заражение червями и западные диеты, является ключом, неизвестным для развивающихся стран. человеческий власоглав Trichuris trichiura и посмотреть, как диета с высоким содержанием жиров влияет на иммунитет».
Ранее было показано, что иммунный ответ, который изгоняет паразита, зависит от лейкоцитов, называемых Т-хелперами 2, специализирующихся на уничтожении желудочно-кишечных паразитов.
Результаты, опубликованные в журнале Mucosal Immunology, демонстрируют, как диета с высоким содержанием жиров, а не само ожирение, увеличивает молекулу на Т-хелперных клетках, называемую ST2, и это обеспечивает усиленный ответ Т-хелперов 2, который изгоняет паразита из организма. слизистая оболочка толстого кишечника
Доктор Джон Уортингтон с факультета биомедицины и биологических наук Ланкастерского университета руководил исследованием.
«Мы были очень удивлены тем, что обнаружили в ходе этого исследования. Диета с высоким содержанием жиров в основном связана с усилением патологии во время болезни. иммунный ответ, чтобы изгнать червя».
Соруководитель профессор Ричард Гренсис из Манчестерского университета сказал: «Наши исследования на мышах на стандартной диете показывают, что ST2 обычно не запускается при изгнании паразита, но диета с высоким содержанием жиров повышает уровень ST2 и, следовательно, позволяет изгнание альтернативным путем».
Соруководитель профессор Дэвид Торнтон из Манчестерского университета добавил: «Было действительно удивительно, что простое изменение диеты полностью изменило иммунный ответ в кишечнике с того, который не может изгнать паразита, на тот, который вызывает все правильные реакции. механизмы его ликвидации».
механизмы его ликвидации».
Однако д-р Уортингтон добавил осторожности к полученным данным.
«Прежде чем вы закажете эту дополнительную еду на вынос, мы ранее сообщали, что потеря веса может помочь изгнанию различных кишечных паразитов. Таким образом, эти результаты могут зависеть от контекста, но что действительно интересно, так это демонстрация того, как диета может глубоко изменить способность вырабатывать защитный иммунитет, и это может дать нам новые подсказки для лечения миллионов людей, страдающих кишечными паразитарными инфекциями во всем мире».
Исследование финансировалось Комиссией по стипендиям Содружества, The Wellcome Trust и EPSRC (Совет по исследованиям в области инженерных и физических наук).
Нелетальные паразиты сокращают количество пищи, которую съедают их дикие хозяева, что приводит к воздействию на экосистему. Источник
Олени, карибу, бизоны и другие подобные животные часто заражаются рядом внутренних паразитов, включая червей, называемых гельминтами.
Новое исследование, проведенное Вашингтонским университетом в Сент-Луисе, использует математическую модель и глобальный метаанализ, чтобы выявить каскадные последствия распространенных паразитарных инфекций у диких животных в наземных экосистемах.
«Паразиты хорошо известны своим негативным воздействием на физиологию и поведение отдельных хозяев и их популяций, но эти эффекты редко рассматриваются в контексте более широких экосистем, в которых они обитают», — сказала Аманда Кольц, старший научный сотрудник отдела биологии в искусстве. & Sciences в Вашингтонском университете, первый автор исследования, опубликованного в Proceedings of the National Academy of Sciences.
«В этом исследовании мы показываем, что широко распространенные паразитарные инфекции снижают уровень травоядных и, следовательно, могут запускать трофические каскады, влияющие на растительные сообщества», — сказал Кольц. «Эта работа помогает заполнить общепризнанный пробел в знаниях об экологических последствиях паразитарных инфекций в природных экосистемах».
«Объединив экспертов в междисциплинарном подходе «Единое здоровье», мы объединили ученых в области здравоохранения, экологии и теоретиков, чтобы расширить традиционные исследования воздействия паразитов на отдельных хозяев и популяции хозяев, чтобы лучше понять эти воздействия на экосистемы, где обитают жвачные животные и их популяции. паразиты живут», — сказала Шарон Дим, директор Института природоохранной медицины зоопарка Сент-Луиса, соавтор нового исследования.
Исследование проводилось междисциплинарной международной рабочей группой, финансируемой организацией Living Earth Collaborative, партнерством Вашингтонского университета, ботанического сада Миссури и зоопарка Сент-Луиса.
Олени, бизоны, жирафы, газели и антилопы — копытные животные, известные как жвачные животные: они вегетарианцы, чьи привычки в еде оказывают ощутимое воздействие на местные экосистемы. Только представьте, сколько зелени может съесть один пасущийся олень в неогороженном саду.
Но каждое дикое жвачное животное представляет собой отдельный мир для множества паразитов, населяющих его кишечник и ткани, когда оно занимается своим обычным делом поедания травы.
В то время как другие недавние исследования показывают, что виды паразитов, которые в конечном итоге убивают своих хозяев, могут вызывать каскадные эффекты в экосистемах, в чем-то схожие с хищниками, в этом исследовании также рассматривалось воздействие несмертельных паразитарных инфекций.
Исследователи использовали математическую модель и глобальный метаанализ, чтобы проверить способность гельминтозов — любой из группы обычных паразитических червей — запускать трофические каскады посредством их летального и сублетального воздействия на жвачных животных-хозяев.
«Потенциал смертельных инфекций, резко увеличивающих смертность хозяина, чтобы иметь последствия на уровне экосистемы, в некоторой степени интуитивно понятен, особенно когда убитые хозяева играют ключевую роль в экосистеме. Например, чума крупного рогатого скота, вирус, убивший миллионы жвачных животных в странах Африки к югу от Сахары до 1960-х годов, изменил плотность деревьев в экосистеме Серенгети, влияя на смертность антилоп гну», — сказала Ванесса Эзенва, профессор экологии и эволюционной биологии Йельского университета. , старший автор исследования. «Наша модель предполагает, что сублетальные инфекции, хотя и более загадочные, могут иметь не менее важные последствия для экосистем; и наш мета-анализ показывает, насколько широко распространены сублетальные эффекты паразитов-гельминтов в природе».
При моделировании под руководством Дейва Сивителло из Университета Эмори использовались хорошо задокументированные примеры карибу, северных оленей и их паразитов. Карибу и их гельминты являются одними из наиболее изученных паразитарных систем диких жвачных животных из-за экологической, экономической и культурной важности карибу в экосистемах тундры и сохраняющихся угроз заболевания системе, создаваемых изменением климата.
«Наши модели позволили нам изучить последствия различных способов, которыми паразиты наносят вред своим хозяевам», — сказала Рэйчел Пенчиковски, доцент кафедры биологии факультета искусств и наук Вашингтонского университета, старший автор исследования. «Мы использовали модели, чтобы проверить влияние паразитарных инфекций на плотность популяции хозяев карибу и на их пищевые ресурсы растений и лишайников.
«Мы обнаружили, что любой из трех типов вреда, причиняемого паразитарными инфекциями, — то есть вред выживанию хозяина, скорости питания или размножению — может вызывать каскадный эффект», — сказала она. «Короче говоря, болезни травоядных имеют значение для растений».
Затем ученые обратились к данным более чем 59 опубликованных, рецензируемых исследований, чтобы изучить связи между гельминтозами и теми же ключевыми характеристиками свободноживущих жвачных животных-хозяев в природе.
Их анализ показал, что гельминтозы значительно снижают скорость питания хозяев, но в среднем не связаны с выживанием или плодовитостью хозяев.
