Депрессия и когнитивные нарушения | «Лечащий врач» – профессиональное медицинское издание для врачей. Научные статьи.
Когнитивные нарушения развиваются у 80-90% пациентов, страдающих депрессией. Об общих звеньях патогенеза, дифференциальной диагностике и особенностях течения аффективных расстройств у пациентов с когнитивными нарушениями – в вебинаре Е.Е. Васениной. | |
partners Ключевые слова / keywords: Аффективные расстройства, Велаксин, Деменция, Депрессия, Когнитивные нарушения, Неврология, Психиатрия, Психоневрология, Affective disorder, Velaxin, Dementia, Depression, Cognitive disorders, Psychiatry, Neuropsychiatry
Васенина Елена Евгеньевна, д. м.н., доцент кафедры неврологии, ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования Минздрава России
м.н., доцент кафедры неврологии, ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования Минздрава России
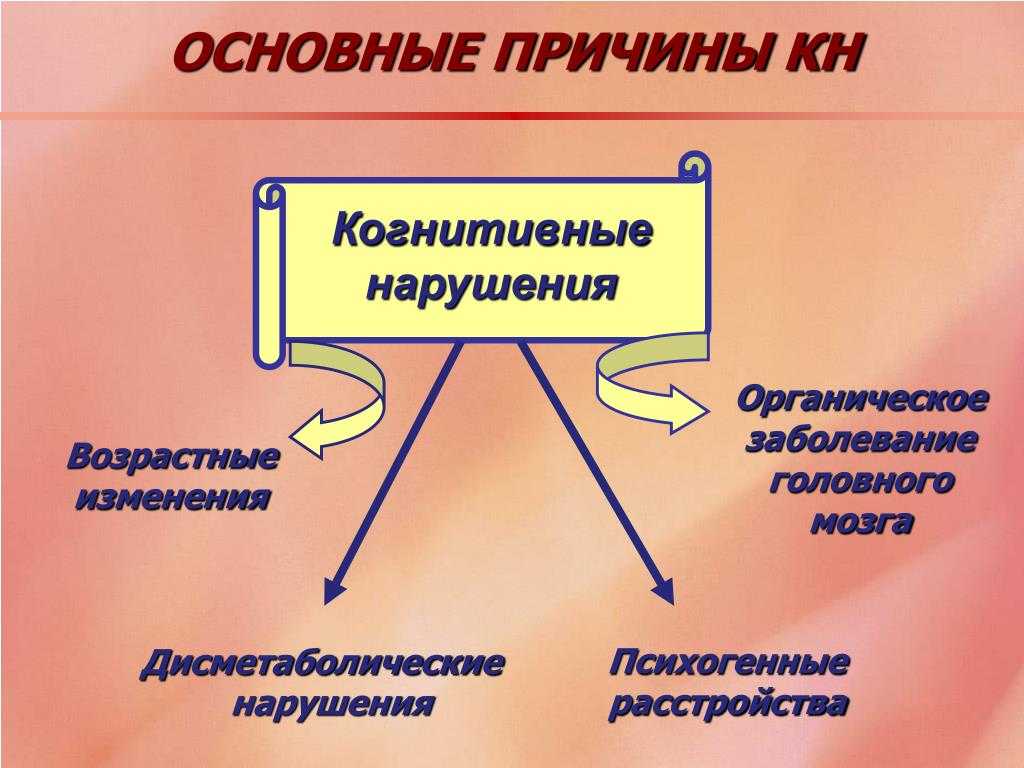
Снижение когнитивных функций выявляется у 80-90% пациентов, страдающих депрессией, а у 30-40% больных когнитивные нарушения персистируют даже при разрешении депрессивного эпизода и стабилизации состояния. У пациентов с депрессией когнитивные нарушения служат предиктором снижения психосоциального функционирования и повышения риска рецидива более чем в 3.5 раза и представляют собой важный фактор ограничения функциональной активности и возможности восстановления.
Коморбидность депрессии и когнитивных расстройств обусловлена морфофункциональными изменениями структур головного мозга, участвующих в реализации функций памяти, мышления, принятия решений и контроля эмоций и поведения. Так, по данным магнитно-резонансной томографии (МРТ), по сравнению с показателями в общей популяции, у пациентов с большим депрессивным расстройством (БДР) наблюдается снижение объема серого вещества префронтальной и орбитофронтальной коры на 19% и 32%, соответственно, а также снижением объема гиппокампа на 10–19%, которое не всегда обусловленного возрастными нейродегенеративными процессами, особенно у лиц молодого возраста.
Среди основных звеньев патогенеза когнитивных расстройств при депрессии выделяют нарушение фронто-стриатальных кругов и нейрогенеза, функциональная деактивация гиппокампа, нарушение сна и нейродегенеративные изменения структур мозга.
Лобная кора является ключевой зоной мозга, обеспечивающей интеграцию информации различных модальностей и реализацию двигательных функций, в частности произвольных движений, мышления и принятия решений, поведения и эмоций. Координация функциональных связей между моторным, окуломоторным, префронтальным, орбитофронтальным и поясным отделами лобной коры осуществляется на уровне подкорковых ганглиев (стриатум) и таламуса. Наличие общих зон пересечения функциональных связей, образуемых между отделами лобной коры, объясняет частую коморбидность не только когнитивных и аффективных, но и двигательных расстройств.
Закономерным следствием длительного течения депрессии и центральным звеном патогенеза когнитивной дисфункции при БДР является лобная дисфункция, в том числе изменение активности и реорганизация функциональных связей дорсолатеральной коры с подкорковыми структурами и другими зонами лобной коры. Развивающиеся на фоне лобной дисфункции умеренные когнитивные расстройства (УКР) с дизрегуляторным нейропсихологическим профилем сопровождаются замедленностью, ригидностью, нарушениями мышления и трудностями переключения внимания. УКР представляют собой гетерогенный синдром, встречающийся как у пациентов с преддементными состояниями, так и у больных, у которых когнитивные нарушения развиваются в рамках аффективных расстройств или вследствие соматических заболеваний. Более чем у 40% пациентов, обратившихся за медицинской помощью с жалобами на трудности мышления и принятия решений, замедленностью когнитивных процессов и нарушениями внимания выявляется депрессия.
Развивающиеся на фоне лобной дисфункции умеренные когнитивные расстройства (УКР) с дизрегуляторным нейропсихологическим профилем сопровождаются замедленностью, ригидностью, нарушениями мышления и трудностями переключения внимания. УКР представляют собой гетерогенный синдром, встречающийся как у пациентов с преддементными состояниями, так и у больных, у которых когнитивные нарушения развиваются в рамках аффективных расстройств или вследствие соматических заболеваний. Более чем у 40% пациентов, обратившихся за медицинской помощью с жалобами на трудности мышления и принятия решений, замедленностью когнитивных процессов и нарушениями внимания выявляется депрессия.
Одной из возможных причин коморбидности депрессии и когнитивных расстройств является нарушение нейрогенеза в зубчатой извилине гиппокампа – ключевой зоне мозга, участвующей в механизме формирования новых воспоминаний посредством образования нейрональных связей со структурами префронтальной коры. Серотонинергическая терапия селективными ингибиторами обратного захвата серотонина (СИОЗС) способствует стимуляции нейрогенеза в этой области, что коррелирует с выраженностью симптомов депрессии и клиническим ответом.
Атрофия гиппокампа у пациентов с БДР отражает снижение нейрогенеза, вызванное нарушением серотонинергической регуляции. Следствием функциональной деактивации гиппокампа у пациентов с БДР является невозможность запоминать новую информацию и возникновение трудностей «переключения» ассоциативных центров, что проявляется в невозможности «многозадачности» в восприятии информации. Эти нарушения в большинстве случаев являются обратимыми и могут регрессировать при своевременном назначении СИОЗС. Степень атрофических изменений, реорганизация и нарушение активности функциональных сетей мозга служат предикторами клинического ответа на терапию антидепрессантами и восстановления пациентов.
Помимо снижения нейрогенеза важную роль в нарушении функции памяти у пациентов с депрессией играют нарушения сна: именно в ночное время происходит реактивация гиппокампа, упорядочивание воспоминаний и формирование долгосрочных «осознанных» автобиографических воспоминаний за счет реактивации неокортекса. Кроме того, на начальных этапах формирования депрессии когнитивные нарушения также могут быть обусловлены нарушением процесса «переключения» активности между гиппокампом и стриатумом, которое реализуется за счет активации глюкокортикоидных и минералокортикоидных рецепторов миндалины на фоне стресса.
Таким образом, основные факторы снижения когнитивных функций у пациентов молодого возраста, страдающих депрессией, включают нарушение функционирования лобно-подкорково-таламических кругов с гипофункцией префронтальной коры, нарушение нейрогенеза в гиппокампе и функциональное переключение между гиппокампом и миндалиной. Формирующиеся на фоне депрессии когнитивные нарушения являются ключевым фактором риска инвалидизации и рецидива даже после разрешения депрессивных эпизодов и могут быть первичной жалобой пациентов при обращении за медицинской помощью.
У пациентов старшего возраста депрессия является предиктором нейродегенеративных изменений в мозге. Среди наиболее распространенных симптомов депрессии, которые коррелируют с риском развития деменции альцгеймеровского и неальцгеймеровского типов, выделяют снижение аппетита и потеря веса. Аффективные расстройства, в свою очередь, могут выступать в качестве раннего симптома нейродегенеративных процессов, особенно у пациентов без истории БДР в анамнезе. Так, симптомы депрессии в пожилом возрасте коррелируют с более высоким уровнем бета-амилоида в задней поясной извилине и области предклинья. Помимо этого, у пожилых пациентов в результате прогрессирующей нейродегенерации могут наблюдаться нарушения функционирования основных нейромедиаторных систем – холинергической (ядро перегородки, базальное ядро Мейнерта, мезопонтинный комплекс), дофаминергической (вентральное ядро покрышки, черная субстанция), норадренергической (голубое пятно) или серотонинергической (ядро шва), ведущие к развитию и прогрессированию нейропсихиатрических симптомов – тревоги, снижения аппетита и эмоциональной вовлеченности, равнодушия и трудностей инициации, которые сложно дифференцировать с когнитивными нарушениями.
В терапии депрессии и когнитивных расстройств предпочтение отдается антидепрессантам серотонинергического действия без выраженного тормозящего/возбуждающего эффекта, способствующих купированию проявлений гипотимии и тревоги, в том числе за счет снижения активности миндалины, усилению нейрогенеза и улучшению восприятия положительных воспоминаний. В то же время не рекомендуется назначение холинергических средств и классических ноотропных препаратов, способных усугублять симптомы тревоги. Дополнительными критериями для назначения антидепрессантов пациентам с коморбидным течением депрессии и когнитивных нарушений являются наличие пролонгированных форм, т.
Нарушения когнитивных функций при шизофрении, их ассоциация с оксидативным стрессом | Пятойкина
1. Гурович И.Я., Шмуклер А.Б., Любов Е.Б., Магомедова М.В., Белокурова Е.А., Дороднова А.С., Мовина Л.Г. Клинико-социальная, нейрокогнитивная и фармакоэкономическая оценка терапии сероквелем больных с первым психотическим эпизодом (второй этап исследования). Социальная и клиническая психиатрия. 2004;14(4):44–51.
Социальная и клиническая психиатрия. 2004;14(4):44–51.
2. Гурович И.Я. Шмуклер А.Б. Саркисян Г.Р. Дороднова А.С., Калашникова И.И., Мовина Л.Г. Комплексная оценка фармакотерапии больных с первым психотическим эпизодом: применение сертиндола. Социальная и клиническая психиатрия. 2010;20(1): 25–32.
3. Зайцева Ю.С., Корсакова Н.К. Динамика нейрокогнитивного дефицита у пациентов с различной степенью прогредиентности шизофрении при первых приступах и в течение 5-летнего катамнеза. Социальная и клиническая психиатрия. 2008;18(2):15-25.
4. Иванов М.В., Янушко М.Г. Фармакотерапевтический подход к коррекции когнитивных нарушений при шизофрении (методические рекомендации для врачей). СПб.: НИПНИ им. В.М. Бехтерева, 2011.
5. Казаковцев Б.А., Творогова Н.А., Николаева Т.А., Демчева Н.К. Распространенность психических расстройств в населении Российской Федерации в 2011 году (аналитический обзор)– М.: ФГБУ «ФМИЦПН» Минздрава России, 2014: 43.
6. Магомедова М.В. Соотношение социального функционирования и нейрокогнитивного дефицита у больных шизофренией и шизоаффективным расстройством на раннем и отдаленном этапе болезни: дис. … канд. мед. наук: 14.00.18. М. 2003: 42.
… канд. мед. наук: 14.00.18. М. 2003: 42.
7. Мовина Л.Г. Психосоциальная терапия больных шизофренией и расстройствами шизофренического спектра с первыми психотически- ми эпизодамию Автореф. дис. на соиск. учен. степ. канд. мед. наук, 2005.
8. Мосолов С.Н. Современная антипсихотическая фармакотерапия шизофрении. Русский медицинский журнал. 2004;12(10):646-652.
9. Мосолов С.Н., Кабанов С.О., Каримулаев И.А., Рывкин П.В. Редукция когнитивных нарушений у больных с первым эпизодом шизофрении и хроническим течением болезни при лечении кветиапином. Психиатрия и психофармакотерапия. 2005;1:6-11.
10. Мосолов С.Н., Калинин В.В., Еремин А.В. Сравнительная эффективность и переносимость нового поколения антипсихотических средств при лечении обострений шизофрении (мета-анализ оригинальных исследований оланзапина, рисперидона, кветиапина, клозапина и галоперидола). Новые достижения в терапии психических заболеваний. М., 2002.
11. Мосолов С.Н., Цукарзи Э.Э., Капилетти С.Г.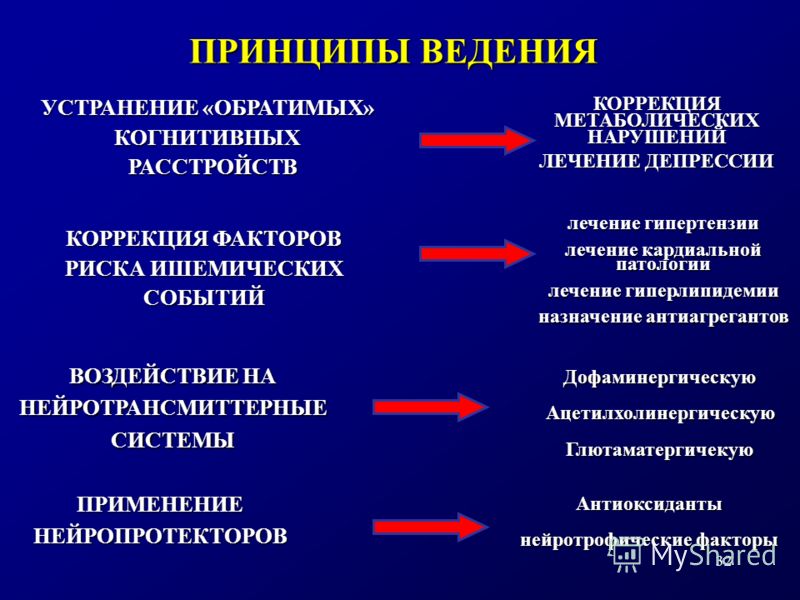 Антипсихотическая фармакотерапия шизофрении: от научных данных к клиническим рекомендациям. Биологические методы терапии психических расстройств. Доказательная медицина — клинической практике. М., 2012.
Антипсихотическая фармакотерапия шизофрении: от научных данных к клиническим рекомендациям. Биологические методы терапии психических расстройств. Доказательная медицина — клинической практике. М., 2012.
12. Панина А.Н. Закономерности изменений показателей нейрокогнитивных функций при параноидной шизофрении при терапии дисс … канд. мед. наук. 2007.
13. Семенова Н.В., Вукс А.Я., Чернов П.Д., Лысенко И.С. Заболеваемость психическими расстройствами населения Северо-Западного федерального округа: Статистические материалы и анализ. СПб: 2018.
14. Софронов А.Г., Спикина А.А., Савельев А.П. Нейрокогнитивный дефицит и Социальное функционирование при шизофрении: комплексная Оценка и возможная коррекция. Социаль- ная и клиническая психиатрия. 2012;22(1):33–37.
15. Янушко М.Г. Антипсихотическая терапия шизофрении: клинические и когнитивные аспекты: дисс … канд. мед. наук. СПб: 2008.
16. American Psychiatric Association. Diagnostic and statistical manual of mental disorders (5th ed). 2013.
2013.
17. Andersen R., Fagerlund B., Rasmussen H., Ebdrup B.H., Aggernaes B., Gade A., Oranje B., Glenthoj B. The influence of impaired processing speed on cognition in first-episode antipsychotic naive schizophrenic patients. European Psychiatry. 2013;28:332–339. https://doi.org/10.1016/j.eurpsy.2012.06.003
18. Andreasen N.C., Nopoulos P., O’Leary D.S. Miller DD, Wassink T, Flaum M. Defining the phenotype of schizophrenia: cognitive dysmetria and its neural mechanisms. Biol. Psychiatr. 1999;46(7):908–920. doi: 10.1016/s0006-3223(99)00152-3
19. Appels M.C.M., Sitskoorn M.M., Westers P., Lems E., Kahn R.S. Cognitive dysfunctions in parents of schizophrenic patients parallel the deficits found in patients. Schizophrenia Research. 2003;63(3): 285–293. https://doi.org/10.1016/S0920-9964(02)00342-0
20. Barnes T.R., Drake R., Paton C., Cooper S.J., Deakin B., Ferrier I.N. et. al. Evidence-based guidelines for the pharmacological treatment of schizophrenia: Updated recommendations from the British Association for Psychopharmacology. J Psychopharmacol. 2020;34(1):3-78. doi: 10.1177/0269881119889296
J Psychopharmacol. 2020;34(1):3-78. doi: 10.1177/0269881119889296
21. Bechi M., Spangaro M., Agostoni G., Bosinelli F., Buonocore M., Bianchi L. et. al. Intellectual and cognitive profiles in patients affected by schizophrenia. J Neuropsychol. 2018;13(3):589-602. doi: 10.1111/jnp.12161
22. Beeraka N.M., Avila-Rodriguez M.F., Aliev G. Recent Reports on Redox Stress-Induced Mitochondrial DNA Variations, Neuroglial Interactions, and NMDA Receptor System in Pathophysiology of Schizophrenia. Mol Neurobiol. 2022. doi: 10.1007/s12035-021-02703-4
23. Bell M.D., Mishara A.L. Does negative symptom change relate to neurocognitive change in schizophrenia? Implications for targeted treatments. Schizophr. Res. 2006;81(1):17-27. doi: 10.1016/j.schres.2005.09.016
24. Berman, K. F., Weinberger, D. R., Shelton, R. C. & Zec, R. F. A relationship between anatomical and physiological brain pathology in schizophrenia: lateral cerebral ventricular size predicts cortical blood flow.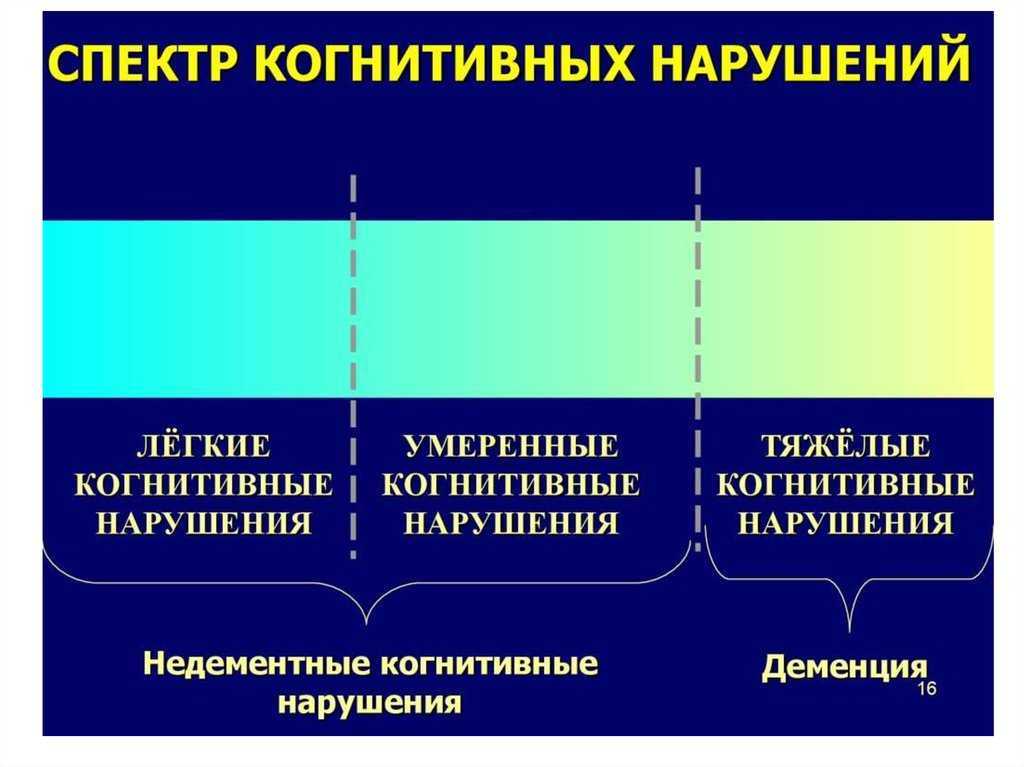 American Journal of Psychiatry. Am J Psychiatry. 1987;144(10):1277-82. doi: 10.1176/ajp.144.10.1277
American Journal of Psychiatry. Am J Psychiatry. 1987;144(10):1277-82. doi: 10.1176/ajp.144.10.1277
25. Beyene G.M., Legas G., Azale T., Abera M., Asnakew S. The magnitude of disability in patients with schizophrenia in North West Ethiopia: A multicenter hospital-based cross-sectional study. Heliyon. 2021;7(5):e07053. doi: 10.1016/j.heliyon.2021.e07053
26. Blanchard J.J., Neale J.M. The neuropsychological signature of schizophrenia: generalized or differential deficit? Am J Psychiatr. 1994;151(1): 40–48.
27. Bosia M., Buonocore M., Bechi M., Spangaro M., Pigoni A., Croci M. et. al. Cognitive remediation and functional improvement in schizophrenia: is it a matter of size? Eur Psychiatry. 2017;40:26-32. doi: 10.1016/j.eurpsy.2016.06.007
28. Braw Y., Bloch Y., Mendelovich S., Ratzoni G., Gal G., Harari H., Tripto A., Levkovitz Y. Cognition in young schizophrenia outpatients: comparison of first-episode with multiepisode patients. Schizophr Bull. 2008;34(3):544-54. doi: 10. 1093/schbul/sbm115
1093/schbul/sbm115
29. Carrión R.E., Walder D.J., Auther A.M., McLaughlin D., Zyla H.O., Adelsheim S. et. al. McFarlane W.R., Cornblatt B.A. From the psychosis prodrome to the first-episode of psychosis: No evidence of a cognitive decline. J Psychiatr Res. 2018;96:231-238. doi:10.1016/j.jpsychires.2017.10.014
30. Cecerska-Heryć E., Polikowska A., Serwin N., Roszak M., Grygorcewicz B., Heryć R., Michalczyk A., Dołęgowska B. Importance of oxidative stress in the pathogenesis, diagnosis, and monitoring of patients with neuropsychiatric disorders, a review. Neurochem Int. 2022;153:105269. doi: 10.1016/j.neuint.2021.105269
31. Censits D.M., Ragland J.D., Gur R.C. Neuropsychological evidence supporting a neurodevelopmental model of schizophrenia. Schizophr Res. 1997;24(3):289–298. doi: 10.1016/s0920-9964(96)00091-6
32. Cornblatt B.A., Carrión R.E., Auther A., McLaughlin D., Olse, R.H., John M., Correll C.U. Psychosis prevention: a modified clinical high risk perspective from the recognition and prevention (RAP) program. Am J Psychiatry. 2015;172(10):986-94. doi: 10.1176/appi.ajp.2015.13121686
Am J Psychiatry. 2015;172(10):986-94. doi: 10.1176/appi.ajp.2015.13121686
33. Cummings J.L. Frontal-subcortical circuits and human behavior. Arch Neurol. 1993;50(8):873-80. doi: 10.1001/archneur.1993.00540080076020
34. Davidson M., Galderisi S., Weiser M., Werbeloff N., Fleischhacker W.W., Keefe R.S. et. al. Cognitive effects of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder: a randomized, open-label clinical trial (EUFEST). Am J Psychiatry. 2009;166(6):675-82. doi: 10.1176/appi.ajp.2008.08060806
35. Désaméricq G., Schurhoff F., Meary A., Szöke A., Macquin-Mavier I., Bachoud-Lévi A.C., Maison P. Long-term neurocognitive effects of antipsychotics in schizophrenia: a network meta-analysis. Eur J Clin Pharmacol. 2014;70(2):127-34. doi: 10.1007/s00228-013-1600-y
36. Dickinson D., Ramsey M. E., Gold J. M. Overlooking the obvious: A meta-analytic comparison of digit symbol coding tasks and other cognitive measures in schizophrenia. Arch Gen Psychiatry. 2007;64(5):532-42. doi: 10.1001/archpsyc.64.5.532
2007;64(5):532-42. doi: 10.1001/archpsyc.64.5.532
37. Durgam S., Cutler A.J., Lu K., Migliore R., Ruth A., Laszlovszky I., Németh G., Meltzer H.Y. Cariprazine in acute exacerbation of schizophrenia: a fixed-dose, phase 3, randomized, double-blind, placebo- and active-controlled trial. J Clin Psychiatry. 2015;76(12):e1574-82. doi: 10.4088/JCP.15m09997
38. Fleischhacker W., Galderisi S., Laszlovszky I., Szatmári B., Barabássy Á., Acsai K. et. al. The efficacy of cariprazine in negative symptoms of schizophrenia: Post hoc analyses of PANSS individual items and PANSS-derived factors. Eur Psychiatry. 2019;58:1-9. doi: 10.1016/j.eurpsy.2019.01.015
39. Fraguas D., Díaz-Caneja C.M., RodríguezQuiroga A., Arango C. Oxidative Stress and Inflammation in Early Onset First Episode Psychosis: A Systematic Review and Meta-Analysis. Int J Neuropsychopharmacol. 2017;20(6): 435–444. doi: 10.1093/ijnp/pyx015
40. Fusar-Poli P., Deste G., Smieskova R., Barlati S., Yung A.R., Howes O. et. al. Cognitive functioning in prodromal psychosis: a meta-analysis. Arch Gen Psychiatry. 2012;69(6):562-71. doi: 10.1001/archgenpsychiatry.2011.1592
et. al. Cognitive functioning in prodromal psychosis: a meta-analysis. Arch Gen Psychiatry. 2012;69(6):562-71. doi: 10.1001/archgenpsychiatry.2011.1592
41. Gaebel W., Zielasek J., Cleveland H.R. Psychotic Disorders in ICD-11. Asian J Psychiatr. 2013;6(3):263-5. doi: 10.1016/j.ajp.2013.04.002
42. Gallhofer B., Jaanson P., Mittoux A., Tanghøj P., Lis S., Krieger S. Course of recovery of cognitive impairment in patients with schizophrenia: a randomised double-blind study comparing sertindole and haloperidol. Pharmacopsychiatry. 2007;40(6):275-86. doi: 10.1055/s-2007-990291
43. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. (2018). Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392(10159):1789-1858. doi: 10.1016/S0140-6736(18)32279-7
44. Gold S., Arndt S. , Nopoulos P., O’Leary D.S., Andreasen N.C. Longitudinal study of cognitive function in first-episode and recent-onset schizophrenia. Am J Psychiatry. 1999;156(9):1342-8. doi: 10.1176/ajp.156.9.1342
, Nopoulos P., O’Leary D.S., Andreasen N.C. Longitudinal study of cognitive function in first-episode and recent-onset schizophrenia. Am J Psychiatry. 1999;156(9):1342-8. doi: 10.1176/ajp.156.9.1342
45. Gonzalez-Liencres C., Tas C., Brown E.C., Erdin S., Onur E., Cubukcoglu Z. et. al. Oxidative stress in schizophrenia: a case-control study on the effects on social cognition and neurocognition. BMC Psychiatry. 2014;14:268. doi: 10.1186/s12888-014-0268-x
46. Green M.F., Harvey P.D. Cognition in schizophrenia: Past, present, and future. Schizophr Res Cogn. 2014;1(1):e1-e9. doi: 10.1016/j.scog.2014.02.001
47. Gu F., Chauhan V., Chauhan A. Glutathione redox imbalance in brain disorders. Curr Opin Clin Nutr Metab Care. 2015;18(1):89-95. doi: 10.1097/MCO.0000000000000134
48. Hartman M., Steketee M.C., Silva S., Lanning K., McCann H. Working memory and schizophrenia: evidence for slowed encoding. Schizophr Res. 2003;59(2-3):99-113. doi: 10.1016/s0920-9964(01)00366-8
49. Harvey P.D., Keefe R.S. Studies of cognitive change in patients with schizophrenia following novel antipsychotic treatment. Am J Psychiatry. 2001;158(2):176-84. doi: 10.1176/appi.ajp.158.2.176
Harvey P.D., Keefe R.S. Studies of cognitive change in patients with schizophrenia following novel antipsychotic treatment. Am J Psychiatry. 2001;158(2):176-84. doi: 10.1176/appi.ajp.158.2.176
50. Harvey P.D., Siu C.O., Hsu J., Cucchiaro J., Maruff P., Loebel A. Effect of lurasidone on neurocognitive performance in patients with schizophrenia: a short-term placebo- and active-controlled study followed by a 6-month double-blind extension. Eur Neuropsychopharmacol. 2013;23(11):1373-82. doi: 10.1016/j.euroneuro.2013.08.003
51. Harvey P.D., Siu C.O., Loebel A.D. Insight and Treatment Outcomes in Schizophrenia: Posthoc Analysis of a Long-term, Double-blind Study Comparing Lurasidone and Quetiapine XR. Innov Clin Neurosci. 2017;14(11-12):23-29.
52. Harvey P.D., Parrella M., White L., Mohs R.C., Davidson M., Davis K.L. Convergence of cognitive and adaptive decline in late-life schizophrenia. Schizophr Res. 1999;35(1):77-84. doi: 10.1016/s0920-9964(98)00109-1
53. Harvey P. D., Green M.F., Keefe R.S., Velligan D.I. Cognitive functioning in schizophrenia: a consensus statement on its role in the definition and evaluation of effective treatments for the illness. J Clin Psychiatry. 2004;65(3):361-72.
D., Green M.F., Keefe R.S., Velligan D.I. Cognitive functioning in schizophrenia: a consensus statement on its role in the definition and evaluation of effective treatments for the illness. J Clin Psychiatry. 2004;65(3):361-72.
54. Heaton R.K., Velin R.A., McCutchan J.A., Gulevich S.J., Atkinson J.H., Wallace M.R. et. al. Neuropsychological impairment in human immunodeficiency virus-infection: implications for employment. HNRC Group. HIV Neurobehavioral Research Center. Psychosom Med. 1994;56(1):8-17. doi: 10.1097/00006842-199401000-00001
55. Jahshan C., Heaton R.K., Golshan S., Cadenhead K.S. Course of neurocognitive deficits in the prodrome and first episode of schizophrenia. Neuropsychology. 2010;24(1):109-120. doi: 10.1037/a0016791
56. Juckel G., de Bartolomeis A., Gorwood P., Mosolov S., Pani L., Rossi A., Sanjuan J. Towards a framework for treatment effectiveness in schizophrenia. Neuropsychiatr Dis Treat. 2014;10:1867-78. doi: 10.2147/NDT.S61672
57. Keefe R. S., Poe M., Walker T.M., Kang J.W., Harvey P.D. The Schizophrenia Cognition Rating Scale: an interview-based assessment and its relationship to cognition, real-world functioning, and functional capacity. Am J Psychiatry. 2006;163(3):426-32. doi: 10.1176/appi.ajp.163.3.426
S., Poe M., Walker T.M., Kang J.W., Harvey P.D. The Schizophrenia Cognition Rating Scale: an interview-based assessment and its relationship to cognition, real-world functioning, and functional capacity. Am J Psychiatry. 2006;163(3):426-32. doi: 10.1176/appi.ajp.163.3.426
58. Kim G.H., Kim J.E., Rhie S.J., Yoon S. The Role of Oxidative Stress in Neurodegenerative Diseases. Exp Neurobiol. 2015;24(4):325-40. doi: 10.5607/en.2015.24.4.325
59. Kim S.J., Jung D.U., Moon J.J., Jeon D.W., Seo Y.S., Jung S.S., Lee Y.C., Kim J.E., Kim Y.S. Relationship between disability self-awareness and cognitive anddaily living function in schizophrenia. Schizophr Res Cogn. 2020;23:100192. doi: 10.1016/j.scog.2020.100192
60. Kitabatake Y., Hikida T., Watanabe D., Pastan I., Nakanishi S. Impairment of reward-related learning by cholinergic cell ablation in the striatum. Proc Natl Acad Sci U S A. 2003;100(13):7965-70. doi: 10.1073/pnas.1032899100
61. Kraepelin, E. Dementia Praecox and Paraphrenia. Robert E. Krieger Publishing Co., LoCo, Huntington, New York. 1971.
Robert E. Krieger Publishing Co., LoCo, Huntington, New York. 1971.
62. Kucharska-Pietura K., Tylec A., Czernikiewicz A., Mortimer A. Attentional and emotional functioning in schizophrenia patients treated with conventional and atypical antipsychotic drugs. Med Sci Monit. 2012;18(1):CR44-49. doi: 10.12659/msm.882202
63. Laszlovszky I., Barabássy Á., Németh G. Cariprazine, A Broad-Spectrum Antipsychotic for the Treatment of Schizophrenia: Pharmacology, Efficacy, and Safety. Adv Ther. 2021;38(7):3652-3673. doi: 10.1007/s12325-021-01797-5
64. Lavoie S., Murray M.M., Deppen P., Knyazeva M.G., Berk M., Boulat O. et. al. Glutathione precursor, N-acetyl-cysteine, improves mismatch negativity in schizophrenia patients. Neuropsychopharmacology. 2008;33(9):2187-99. doi: 10.1038/sj.npp.1301624
65. Lee M.A., Jayathilake K., Meltzer H.Y. A comparison of the effect of clozapine with typical neuroleptics on cognitive function in neuroleptic-responsive schizophrenia. Schizophr Res. 1999;37(1):1-11. doi: 10.1016/s0920-9964(98)00145-5
1999;37(1):1-11. doi: 10.1016/s0920-9964(98)00145-5
66. Leeson V.C., Barnes T.R., Harrison M., Matheson E., Harrison I., Mutsatsa S.H., Ron M.A., Joyce E.M. The relationship between IQ, memory, executive function, and processing speed in recent-onset psychosis: 1-year stability and clinical outcome. Schizophr Bull. 2010;36(2):400-9. doi: 10.1093/schbul/sbn100
67. Maas D.A., Vallès A., Martens G.J.M. Oxidative stress, prefrontal cortex hypomyelination and cognitive symptoms in schizophrenia. Transl Psychiatry. 2017;7(7):e1171. doi: 10.1038/tp.2017.MarinO. Developmental timing and critical windows for the treatment of psychiatric disorders. Nat Med. 2016;22:1229–1238. doi: 10.1038/nm.4225
68. Martinez-Cengotitabengoa M., Mac-Dowell K.S., Leza J.C., Mico J.A., Fernandez M., Echevarria E. et. al. Cognitive impairment is related to oxidative stress and chemokine levels in first psychotic episodes. Schizophr Res. 2012;137(1–3):66–72. doi: 10.1016/j.schres.2012.03.004
69. Maslenikov N., Tsukarzi E., Mosolov S. Repetitive Transcranial Magnetic Stimulation (rTMS) for the treatment of depression in schizophrenia patients. Ann Gen Psych. 2008;7(1): 312.
Maslenikov N., Tsukarzi E., Mosolov S. Repetitive Transcranial Magnetic Stimulation (rTMS) for the treatment of depression in schizophrenia patients. Ann Gen Psych. 2008;7(1): 312.
70. Matsuzawa D., Obata T., Shirayama Y., Nonaka H., Kanazawa Y., Yoshitome E. et. al. Negative correlation between brain glutathione level and negative symptoms in schizophrenia: a 3T 1H-MRS study. PLoS One. 2008;3(4):e1944. doi: 10.1371/journal.pone.0001944
71. Meltzer H.Y., Share D.B., Jayathilake K., Salomon R.M., Lee M.A. Lurasidone Improves Psychopathology and Cognition in Treatment-Resistant Schizophrenia. J Clin Psychopharmacol. 2020;40(3):240-249. doi: 10.1097/JCP.0000000000001205
72. Miller B.J., Pikalov A., Siu C.O., Tocco M., Tsai J., Harvey P.D., Newcomer J.W., Loebel A. Insight and Treatment Outcomes in Schizophrenia: Posthoc Analysis of a Long-term, Double-blind Study Comparing Lurasidone and Quetiapine XR.. Compr Psychiatry. 2020;102:152195. doi: 10.1016/j.comppsych.2020.152195
73. Neill J.C., Grayson B., Kiss B., Gyertyán I., Ferguson P., Adham N. Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizophrenia symptomatology. Eur Neuropsychopharmacol. 2016;26(1):3-14. doi: 10.1016/j.euroneuro.2015.11.016
Neill J.C., Grayson B., Kiss B., Gyertyán I., Ferguson P., Adham N. Effects of cariprazine, a novel antipsychotic, on cognitive deficit and negative symptoms in a rodent model of schizophrenia symptomatology. Eur Neuropsychopharmacol. 2016;26(1):3-14. doi: 10.1016/j.euroneuro.2015.11.016
74. Newton D.F., Naiberg M.R., Goldstein B.I. Oxidative stress and cognition amongst adults without dementia or stroke: implications for mechanistic and therapeutic research in psychiatric disorders. Psychiatry Res 2015;227(2–3):127–34. doi: 10.1016/j.psychres.2015.03.038
75. Nuechterlein K.H., Barch D.M., Gold J.M., Goldberg T.E., Green M.F., Heaton R.K. Identification of separable cognitive factors in schizophrenia. Schizophr Res. 2004;72(1):29-39. doi: 10.1016/j.schres.2004.09.007
76. Nuyen J., Sitskoorn M.M., Cahn W., Kahn R.S. Verbal memory in first-episode schizophrenia: heterogeneity in performance? J Int Neuropsychol Soc. 2005;11(2):152-62. doi: 10.1017/s1355617705050162
77. Ogino S., Miyamoto S., Tenjin T., Kitajima R., Ojima K., Miyake N. et. al. Effects of discontinuation of long-term biperiden use on cognitive function and quality of life in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2011;35(1):78-83. doi: 10.1016/j.pnpbp.2010.08.030
Ogino S., Miyamoto S., Tenjin T., Kitajima R., Ojima K., Miyake N. et. al. Effects of discontinuation of long-term biperiden use on cognitive function and quality of life in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry. 2011;35(1):78-83. doi: 10.1016/j.pnpbp.2010.08.030
78. Ojeda N., Sánchez P., Peña J., Elizagárate E., Yoller A.B., Gutiérrez-Fraile M., Ezcurra J., Napal O. An explanatory model of quality of life in schizophrenia: the role of processing speed and negative symptoms. Actas Esp Psiquiatr. 2012;40(1):10-8.
79. Ojeda N., Sánchez P., Peña J., Elizagárate E., Yoller A.B., Larumbe J., Gutiérrez M., Casais L., Ezcurra J. Verbal fluency in schizophrenia: does cognitive performance reflect the same underlying mechanisms in patients and healthy controls? J Nerv Ment Dis. 2010;198(4):286-91. doi: 10.1097/NMD.0b013e3181d61748
80. Manna P., Jain S.K. Obesity, Oxidative Stress, Adipose Tissue Dysfunction, and the Associated HealthRisks: Causes and Therapeutic Strategies. Metab Syndr Relat Disord. 2015;13(10):423-44. doi: 10.1089/met.2015.0095
Metab Syndr Relat Disord. 2015;13(10):423-44. doi: 10.1089/met.2015.0095
81. Prouteau A., Verdoux H., Briand C., Lesage A., Lalonde P., Nicole L., Reinharz D., Stip E. Cognitive predictors of psychosocial functioning outcome in schizophrenia: a follow-up study of subjects participating in a rehabilitation program. Schizophr Res. 2005;77(2-3):343-53. doi: 10.1016/j.schres.2005.03.001
82. Pukrop R., Ruhrmann S., Schultze-Lutter F., Bechdolf A., Brockhaus-Dumke A., Klosterkötter J. Neurocognitive indicators for a conversion to psychosis: comparison of patients in a potentially initial prodromal state who did or did not convert to a psychosis. Schizophr Res. 2007;92(1-3):116-25. doi: 10.1016/j.schres.2007.01.020
83. Rodríguez-Sánchez J.M., Crespo-Facorro B., González-Blanch C., Perez-Iglesias R., Vázquez-Barquero J.L.; PAFIP Group Study. Cognitive dysfunction in first-episode psychosis: the processing speed hypothesis. Br J Psychiatry Suppl. 2007;51:107-10. doi: 10.1192/bjp.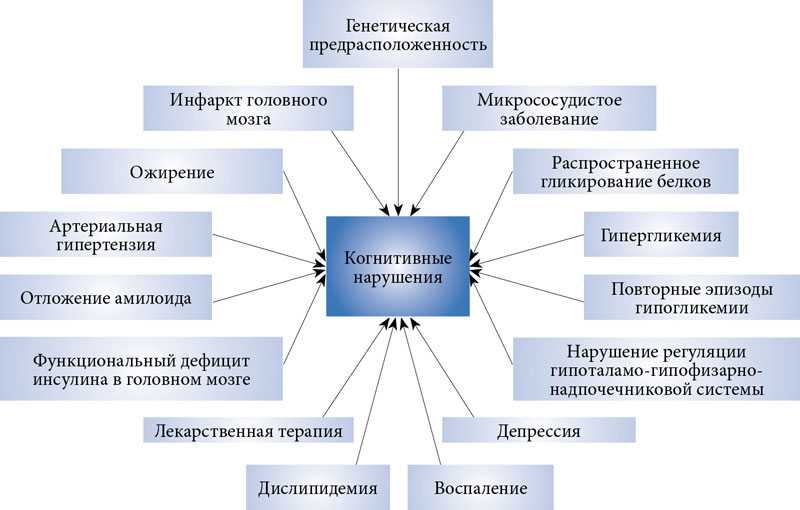 191.51.s107
191.51.s107
84. Ruiz J.C., Soler M.J., Fuentes I., Tomás P. Intellectual functioning and memory deficits in schizophrenia. Compr Psychiatry. 2007;48(3):276-82. doi: 10.1016/j.comppsych.2006.11.002
85. Samuni Y., Goldstein S., Dean O.M., Berk M. The chemistry and biological activities of N-acetylcysteine. Biochim Biophys Acta. 2013;1830(8):4117-29. doi: 10.1016/j.bbagen.2013.04.016
86. Sánchez P., Ojeda N., Peña J., Elizagárate E., Yoller A.B., Gutiérrez M., Ezcurra J. Predictors of longitudinal changes in schizophrenia: the role of processing speed. J Clin Psychiatry. 2009;70(6):888-96. doi: 10.4088/JCP.08m04294
87. Seidman L.J., Shapiro D.I., Stone W.S., Woodberry K.A., Ronzio A., Cornblatt B.A. et. al. Association of Neurocognition With Transition to Psychosis: Baseline Functioning in the Second Phase of the North American Prodrome Longitudinal Study. JAMA Psychiatry. 2016;73(12):1239-1248. doi: 10.1001/jamapsychiatry.2016.2479
88. Şimşek Ş., Gençoğlan S. , Yüksel T., Kaplan İ., Alaca R., Aktaş H. Oxidative Stress and DNA Damage in Untreated First-Episode Psychosis in Adolescents. Neuropsychobiology. 2016;73(2):92-7. doi: 10.1159/000444488
, Yüksel T., Kaplan İ., Alaca R., Aktaş H. Oxidative Stress and DNA Damage in Untreated First-Episode Psychosis in Adolescents. Neuropsychobiology. 2016;73(2):92-7. doi: 10.1159/000444488
89. Slack S.E., Pezet S., McMahon S.B., Thompson S.W.N., Malcangio M. Brain-derived neurotrophic factor induces NMDA receptor subunit one phosphorylation via ERK and PKC in the rat spinal cord. Eur J Neurosci 2004;20(7):1769–78. doi: 10.1111/j.1460-9568.2004.03656.x
90. Takeuchi H., Suzuki T., Remington G., Bies R.R., Abe T., Graff-Guerrero A. et. al. Effects of risperidone and olanzapine dose reduction on cognitive function in stable patients with schizophrenia: an open-label, randomized, controlled, pilot study. Schizophr Bull. 2013;39(5):993-8. doi: 10.1093/schbul/sbt090
91. Talarowska M., Gałecki P., Maes M., Gardner A., Chamielec M., Orzechowska A., Bobińska K., Kowalczyk E. Malondialdehyde plasma concentration correlates with declarative and working memory in patients with recurrent depressive disorder. Mol Biol Rep. 2012;39(5):5359-66. doi: 10.1007/s11033-011-1335-8
Mol Biol Rep. 2012;39(5):5359-66. doi: 10.1007/s11033-011-1335-8
92. Vaskinn A., Ueland T., Melle I., Agartz I., Andreassen O.A., Sundet K. Neurocognitive Decrements are Present in Intellectually Superior Schizophrenia. Front Psychiatry. 2014;5:45. doi: 10.3389/fpsyt.2014.00045
93. Weinberger D. R., Kleinman, J. E. Observations on the brain in schizophrenia. Psychiatry update: the American Psychiatric Association Annual Review. 1986;5:147-149.
94. Welham J., Isohanni M., Jones P., McGrath J. The antecedents of schizophrenia: a review of birth cohort studies. Schizophr Bull. 2009;35(3):603-23. doi: 10.1093/schbul/sbn084
95. Woodward N.D., Purdon S.E., Meltzer H.Y., Zald D.H. A meta-analysis of neuropsychological change to clozapine, olanzapine, quetiapine, and risperidone in schizophrenia. Int J Neuropsychopharmacol. 2005;8(3):457-72. doi: 10.1017/S146114570500516X
96. Wykes T., Huddy V., Cellard C., McGurk S.R., Czobor P. A meta-analysis of cognitive remediation for schizophrenia: methodology and effect sizes. Am J Psychiatry. 2011;168(5):472-85. doi: 10.1176/appi.ajp.2010.10060855
Am J Psychiatry. 2011;168(5):472-85. doi: 10.1176/appi.ajp.2010.10060855
97. Yasui-Furukori N. Update on the development of lurasidone as a treatment for patients with acute schizophrenia. Drug Des Devel Ther. 2012;6:107-15. doi: 10.2147/DDDT.S11180
98. Zavodnick A.D., Ali R. N-acetylcysteine and metabotropic glutamate receptors: implications for the treatment of schizophrenia: a literature review. Psychiatr Q 2014;85(2):177–85. doi: 10.1007/s11126-013-9281-3
99. Zhang X.Y., Chen D.C., Tan Y.L., Tan S.P., Wang Z.R., Yang F.D. et. al. The interplay between BDNF and oxidative stress in chronic schizophrenia. Psychoneuroendocrinology. 2015;51:201-8. doi: 10.1016/j.psyneuen.2014.09.029
100. Zhang X.Y., Yao J.K. Oxidative stress and therapeutic implications in psychiatric disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2013;46:197-9. doi: 10.1016/j.pnpbp.2013.03.003. Epub 2013 Mar 21.
101. Zhang T., Li H., Stone W.S., Woodberry K.A., Seidman L.J., Tang Y. et. al. Neuropsychological Impairment in Prodromal, First-Episode, and Chronic Psychosis: Assessing RBANS Performance. PLoS One. 2015;10(5):e0125784. doi: 10.1371/journal.pone.0125784
et. al. Neuropsychological Impairment in Prodromal, First-Episode, and Chronic Psychosis: Assessing RBANS Performance. PLoS One. 2015;10(5):e0125784. doi: 10.1371/journal.pone.0125784
Существующие лекарства предотвращают связанные с болезнью Альцгеймера когнитивные нарушения у мышей, как показало новое исследование
Нагрузка Aβ на сосуды, активация эндотелиальной каспазы-3, микрокровоизлияния и сужение микрососудов уменьшаются с помощью CAI. Кредит: Болезнь Альцгеймера и деменция (2023). DOI: 10.1002/alz.13063 Изменения в кровеносных сосудах головного мозга, связанные с накоплением липкого белка, известного как бета-амилоид, являются отличительной чертой ранней стадии болезни Альцгеймера. По мере накопления амилоида на стенках сосудов клетки головного мозга теряют питательные вещества и кислород, воспаляются и становятся дисфункциональными. Со временем это приводит к церебральной амилоидной ангиопатии (ЦАА), основной причине снижения когнитивных функций, связанного со старением.
Обращение вспять эффектов CAA и нейровоспаления может принести значительную пользу людям с риском развития болезни Альцгеймера, и теперь новое исследование в Медицинской школе Льюиса Каца при Университете Темпл делает эту надежду доступной. В экспериментах, проведенных на мышах, ученые Темпла показали, что препараты, известные как ингибиторы карбоангидразы (CAI), уже одобренные FDA для лечения других состояний, таких как глаукома и высотная болезнь, способствуют выведению бета-амилоида из кровеносных сосудов и глиальных клеток. клетки, которые контролируют воспалительные процессы в головном мозге. При этом CAI не только уменьшают воспаление и восстанавливают функцию клеток, но и предотвращают когнитивные нарушения.
Исследование проводилось в лаборатории Сильвии Фоссати, доктора философии, адъюнкт-профессора нейронных и сердечно-сосудистых наук в Медицинской школе Льюиса Каца в Университете Темпл, и является первым испытанием одобренных FDA CAI ацетазоламида и метазоламид у животных с цереброваскулярными изменениями, имитирующими ЦАА и болезнь Альцгеймера у людей. Результаты были опубликованы в Интернете в журнале Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association .
Результаты были опубликованы в Интернете в журнале Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association .
«Когнитивные нарушения тесно связаны с повреждением кровеносных сосудов и воспалением в головном мозге, которые являются одними из основных причин, но также и последствий накопления амилоида», — пояснил д-р Фоссати, который также является заместителем директора Центра болезни Альцгеймера в Темплс. Медицинская школа Каца.
«Мы хотели посмотреть, сможем ли мы предотвратить цереброваскулярную дисфункцию, воспаление и улучшить когнитивные функции путем терапевтического улучшения здоровья сосудистых и глиальных клеток, тем самым способствуя удалению амилоида из кровеносных сосудов и тканей головного мозга».
В предыдущей работе д-р Фоссати и его коллеги обнаружили, что накопление амилоида вызывает аномальное функционирование митохондрий — генерирующих энергию клеток — и что этот процесс связан с активностью фермента карбоангидразы. «Мы также знаем из экспериментов на клетках, что CAI подавляют митохондриальную дисфункцию и гибель клеток, вызванную амилоидом», — сказал доктор Фоссати. «Но возникают ли такие же эффекты в естественных условиях, неизвестно».
«Но возникают ли такие же эффекты в естественных условиях, неизвестно».
Для тестирования CAI in vivo д-р Фоссати и его коллеги использовали модель на мышах, в которой животные с возрастом демонстрируют повышение уровня амилоидного белка человека в головном мозге. По мере накопления амилоидных отложений в сосудах головного мозга у животных начинают проявляться признаки цереброваскулярной дисфункции, подобно тому, как у людей появляются признаки ЦАА.
Животных лечили либо ацетазоламидом, либо метазоламидом, начиная примерно с 8-месячного возраста, когда у этих животных впервые появляются признаки амилоидной патологии, и примерно до 15-16 месяцев, когда присутствуют выраженные когнитивные нарушения.
Когда исследователи изучили мозговую ткань мышей, получавших CAI, они обнаружили значительное снижение содержания амилоида в сосудах головного мозга и глиальных клетках. Они также обнаружили, что глиальные клетки и кровеносные сосуды в целом были более здоровыми и обладали лучшей способностью очищать амилоиды по сравнению с необработанными животными.
«И ацетазоламид, и метазоламид были очень эффективны в уменьшении отложений амилоида и в улучшении цереброваскулярной функции», — сказал д-р Фоссати. «Наши поведенческие исследования показали, что по мере уменьшения патологии Альцгеймера у мышей, получавших CAI, наблюдалось заметное улучшение когнитивных функций».
Дополнительные анализы были сосредоточены на посмертных тканях головного мозга пациентов с болезнью Альцгеймера. Эти анализы показали, что, как и у животных, уровни специфического фермента карбоангидразы, обнаруживаемые в митохондриях, аномально повышены в мозге пациентов с болезнью Альцгеймера и пациентов с ВГА. Эти данные впервые идентифицируют карбоангидразу как ключевой фактор у людей, страдающих этими состояниями.
Группа планирует разработать и исследовать CAI, которые более специфичны для митохондрий, с помощью Марка Илиеса, доктора философии, профессора кафедры фармацевтических наук Фармацевтической школы Темпл.
«Терапия, которую мы использовали в текущем исследовании, нацелена на карбоангидразы во всей клетке», — объяснил доктор Фоссати. «Если мы сможем нацелить фермент конкретно на митохондрии, эффективность терапии может значительно повыситься, а побочные эффекты могут быть уменьшены».
«Если мы сможем нацелить фермент конкретно на митохондрии, эффективность терапии может значительно повыситься, а побочные эффекты могут быть уменьшены».
Тем не менее, вскоре могут начаться клинические испытания для проверки эффективности ацетазоламида и метазоламида против CAA у людей, поскольку оба препарата уже одобрены FDA.
Дополнительная информация: Elisa Canepa et al. Одобренные FDA ингибиторы карбоангидразы уменьшают патологию бета-амилоида и улучшают когнитивные функции за счет улучшения здоровья сосудов головного мозга и состояния глии, Alzheimer’s & Dementia (2023). DOI: 10.1002/alz.13063
Предоставлено Университет Темпл
Цитата :
Новые исследования показывают, что существующие лекарства предотвращают когнитивные нарушения, связанные с болезнью Альцгеймера, у мышей (26 апреля 2023 г. )
получено 28 апреля 2023 г.
с https://medicalxpress.com/news/2023-04-drugs-alzheimer-disease-related-cognitive-impairment.html
)
получено 28 апреля 2023 г.
с https://medicalxpress.com/news/2023-04-drugs-alzheimer-disease-related-cognitive-impairment.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Исследование самого сложного симптома психоза | Новости
Этот веб-сайт не будет корректно работать в Internet Explorer 11, поэтому настоятельно рекомендуется установить последнюю версию браузера. Поддержка Internet Explorer 11 прекратится и будет прекращена 15 июня 2022 г. Дополнительные сведения об обновлении см. на сайте browser-update.org.
7-минутное чтение
7-минутное чтение
Прослушать эту статью
Исследования для изучения наиболее сложного симптома психозаПоломка времени аудио 00:00 / 00:00
Прошедшее время:00:00Общее время:00:00
Ваш браузер не поддерживает элемент audio . Вместо этого загрузите аудио .
Психотические расстройства затрагивают около 1% населения во всем мире. Они являются одними из самых тяжелых и инвалидизирующих психических расстройств и имеют непропорционально высокие социальные и экономические издержки [PDF 1519 КБ].
Поиск способов вмешательства как можно раньше — один из самых эффективных способов уменьшить бремя психоза. Вот где приходит наше финансирование.
Понимание когнитивных нарушений при психозе
Хотя психоз обычно ассоциируется с галлюцинациями и бредом, одним из наиболее сложных симптомов для людей, страдающих психотическими расстройствами, является влияние, которое он может оказывать на когнитивные функции. Это может варьироваться от трудностей с определением эмоций других людей до потери памяти или проблем с принятием решений.
Это может варьироваться от трудностей с определением эмоций других людей до потери памяти или проблем с принятием решений.
Эти симптомы часто появляются задолго до первого психотического эпизода и продолжаются по мере развития состояния. Это может иметь серьезные и инвалидизирующие последствия для чьей-либо жизни, затрагивая их отношения, занятость и способность выполнять повседневные задачи.
Однако существует очень мало возможностей для прогнозирования, оценки или лечения когнитивных нарушений. Вот почему мы финансируем исследования, которые одновременно тестируют новые методы лечения и изучают будущие возможности для вмешательств.
Финансирование улучшения когнитивных функций
«Мы сталкиваемся с серьезной проблемой в прогнозировании, оценке и лечении когнитивных нарушений у людей с психозом или с риском его развития. Вот почему я рад, что мы финансируем гранты, которые тестируют новые методы лечения и изучают будущие возможности для вмешательств.
Я горжусь тем, что все проекты будут тесно сотрудничать с людьми, которые пережили психоз, для совместной разработки своих исследований, гарантируя, что их голоса и точки зрения будут в центре исследования.
Наша команда с нетерпением ждет возможности поработать с этим разнообразным портфолио проектов, начиная от терапии сна, виртуальной реальности, фармакологического лечения, транскраниальной магнитной стимуляции и заканчивая приложениями для смартфонов».
Проекты, которым мы присудили
Узнайте больше о проектах, которые мы финансируем:
Можно ли использовать иммерсивную виртуальную реальность для улучшения социального познания у молодых людей с ранним психозом? Профессор Эндрю Томпсон и доктор Роос Пот-Колдер
University of Melbourne, Australia
Психотические расстройства впервые начинают проявляться в подростковом возрасте. Одним из симптомов, оказывающих наибольшее влияние на качество жизни, является нарушение социального познания, то есть способности обрабатывать и использовать социальную информацию. Иммерсивная виртуальная реальность (VR) была определена как инновационный инструмент, поскольку он решает многие текущие проблемы лечения и особенно привлекает молодых людей. Тем не менее, лечение виртуальной реальностью не было разработано специально для улучшения социального познания при раннем психозе. Профессор Томпсон и доктор Пот-Колдер возглавят группу по совместной разработке и оценке VR-терапии для улучшения нарушений социального познания и социального функционирования у молодых людей с ранним психозом.
Иммерсивная виртуальная реальность (VR) была определена как инновационный инструмент, поскольку он решает многие текущие проблемы лечения и особенно привлекает молодых людей. Тем не менее, лечение виртуальной реальностью не было разработано специально для улучшения социального познания при раннем психозе. Профессор Томпсон и доктор Пот-Колдер возглавят группу по совместной разработке и оценке VR-терапии для улучшения нарушений социального познания и социального функционирования у молодых людей с ранним психозом.
Профессор Дэниел Фриман
Оксфордский университет, Великобритания
Нарушения сна очень распространены у пациентов с психозом, но их редко лечат. Профессор Фримен и его команда разработали терапию из восьми сеансов для лечения проблем со сном при психозах — от контроля стимулов до методов десенсибилизации в спальне, когда это было связано с прошлой травмой. В крупнейшем в своем роде исследовании команда будет выяснять, приносит ли лечение проблем со сном другие преимущества, такие как когнитивные функции и психические симптомы, у людей на ранних стадиях психоза.
В крупнейшем в своем роде исследовании команда будет выяснять, приносит ли лечение проблем со сном другие преимущества, такие как когнитивные функции и психические симптомы, у людей на ранних стадиях психоза.
Профессор Белинда Леннокс
Оксфордский университет, Великобритания
Все лицензированные фармакологические методы лечения психоза действуют путем блокирования передачи сигналов дофамина. Эти препараты не приводят к улучшению когнитивных функций, что является основным симптомом, связанным с ранним психозом. Независимые направления исследований недавно выявили несколько молекул с терапевтическим потенциалом, которые вместо этого действуют на мускариновую, эндоканнабиноидную и глутаматергическую передачу сигналов. Профессор Леннокс и ее команда изучат эти недофаминергические вмешательства на предмет когнитивных симптомов и изучат, как улучшение когнитивных функций может привести к изменению качества жизни людей, страдающих ранним психозом.
Dr Anil Malhotra
Feinstein Institutes for Medical Research, USA
Предыдущие исследования показали, что социальные когнитивные функции состоят из нескольких компонентов, которые включают в себя базовые навыки обнаружения эмоций и более высокие социальные когнитивные функции, называемые фактором «ментализации». . В этом исследовании д-р Малхотра и его команда изучат, улучшает ли повторяющаяся транскраниальная магнитная стимуляция (неинвазивная процедура, в которой используются магнитные поля для воздействия на мозговую активность) области мозга, связанной с фактором ментализации, социальные когнитивные способности у молодых людей с психоза в начале болезни.
Каким образом измерения сна могут помочь в проведении мероприятий для детей и молодых людей с высоким риском развития психоза? Профессор Мэтт Джонс
Бристольский университет, Великобритания
Доказательства связывают сон как с когнитивной функцией, так и с риском психоза. Однако детали того, когда и как сон влияет на них, остаются неясными. В этом исследовании профессор Джонс и его междисциплинарная группа оценят, можно ли использовать сон для определения индивидуального ухода за детьми и молодыми людьми с генетически высоким риском развития психоза. Для этого они будут использовать продольные измерения поведения сна и нейрофизиологии, а также когнитивные и клинические оценки для совместной разработки, тестирования и проверки градуированных показателей сна и когнитивных функций с использованием носимых технологий и показателей на основе приложений.
Однако детали того, когда и как сон влияет на них, остаются неясными. В этом исследовании профессор Джонс и его междисциплинарная группа оценят, можно ли использовать сон для определения индивидуального ухода за детьми и молодыми людьми с генетически высоким риском развития психоза. Для этого они будут использовать продольные измерения поведения сна и нейрофизиологии, а также когнитивные и клинические оценки для совместной разработки, тестирования и проверки градуированных показателей сна и когнитивных функций с использованием носимых технологий и показателей на основе приложений.
Dr John Torous
Медицинский центр Beth Israel Deaconess, США и Индия
Для людей, страдающих психозом, не существует клинически доступных методов быстрой оценки или мониторинга когнитивных функций в режиме реального времени. Это отсутствие измерения ограничило наше понимание и эффективное лечение этих симптомов. Доктор Тороус и его команда уже разработали и опробовали приложение mindLAMP с открытым исходным кодом, которое может предлагать оценку скорости обработки данных и рабочей памяти на смартфоне. В этом исследовании они оценят, можно ли использовать расширенную батарею тестов для сбора когнитивных данных для людей, страдающих ранним психозом.
Доктор Тороус и его команда уже разработали и опробовали приложение mindLAMP с открытым исходным кодом, которое может предлагать оценку скорости обработки данных и рабочей памяти на смартфоне. В этом исследовании они оценят, можно ли использовать расширенную батарею тестов для сбора когнитивных данных для людей, страдающих ранним психозом.
Dr Claudia Danielmeier
Университет Ноттингема, Великобритания
Текущие вмешательства, направленные на улучшение когнитивных функций при психозе, полезны для одних людей, но не для других. Различия в результатах лечения могут быть связаны с основными нейротрансмиттерами, такими как глутамат. Доктор Даниэльмайер возглавит группу, изучающую, могут ли изменения уровня глутамата выступать в качестве нового маркера результатов когнитивного лечения у людей с первым эпизодом психоза. Они будут измерять изменения уровня глутамата в мозге, в то время как участники выполняют когнитивную задачу и проверяют, может ли она предсказать изменения в познании.
Профессор Андре Маркуанд
Медицинский центр Университета Радбауд, Нидерланды
Когнитивные нарушения распространены при раннем психозе и существенно влияют на качество жизни. Профессор Марканд и его команда будут моделировать когнитивные данные десятков тысяч людей с психозом и без него, чтобы определить ранние факторы риска психоза. Они разработают технологию глубокого обучения для сбора больших объемов когнитивных данных, картирования изменений в течение жизни и когнитивных областей, а также определения методов прогнозирования начала и прогрессирования психоза.
Что дальше с финансированием нашего психиатрического обслуживания?
Углубляя наше понимание когнитивных нарушений и способы, которыми мы можем выявлять, прогнозировать и вмешиваться как можно раньше, мы надеемся удовлетворить неудовлетворенные потребности людей, страдающих или подверженных риску психоза.