Стереть из памяти — Single by JANAGA on Apple Music
Стереть из памяти — Single by JANAGA on Apple MusicСтереть из памяти
- Algeria
- Angola
- Armenia
- Azerbaijan
- Bahrain
- Benin
- Botswana
- Cameroun
- Cape Verde
- Chad
- Côte d’Ivoire
- Congo, The Democratic Republic Of The
- Egypt
- Eswatini
- Gabon
- Gambia
- Ghana
- Guinea-Bissau
- India
- Iraq
- Israel
- Jordan
- Kenya
- Kuwait
- Lebanon
- Liberia
- Libya
- Madagascar
- Malawi
- Mali
- Mauritania
- Mauritius
- Morocco
- Mozambique
- Namibia
- Niger (English)
- Nigeria
- Oman
- Qatar
- Congo, Republic of
- Rwanda
- Saudi Arabia
- Senegal
- Seychelles
- Sierra Leone
- South Africa
- Sri Lanka
- Tajikistan
- Tanzania, United Republic Of
- Tunisia
- Turkmenistan
- United Arab Emirates
- Uganda
- Yemen
- Zambia
- Zimbabwe
- Australia
- Bhutan
- Cambodia
- 中国大陆
- Fiji
- 香港
- Indonesia (English)
- 日本
- Kazakhstan
- 대한민국
- Kyrgyzstan
- Lao People’s Democratic Republic
- 澳門
- Malaysia (English)
- Maldives
- Micronesia, Federated States of
- Mongolia
- Myanmar
- Nepal
- New Zealand
- Papua New Guinea
- Philippines
- Singapore
- Solomon Islands
- 台灣
- Thailand
- Tonga
- Turkmenistan
- Uzbekistan
- Vanuatu
- Vietnam
- Armenia
- Österreich
- Belarus
- Belgium
- Bosnia and Herzegovina
- Bulgaria
- Croatia
- Cyprus
- Czech Republic
- Denmark
- Estonia
- Finland
- France (Français)
- Georgia
- Deutschland
- Greece
- Hungary
- Iceland
- Ireland
- Italia
- Kosovo
- Latvia
- Lithuania
- Luxembourg (English)
- Malta
- Moldova, Republic Of
- Montenegro
- Nederland
- North Macedonia
- Norway
- Poland
- Portugal (Português)
- Romania
- Россия
- Serbia
- Slovakia
- Slovenia
- España
- Sverige
- Schweiz
- Turkey
- Ukraine
- United Kingdom
- Anguilla
- Antigua and Barbuda
- Argentina (Español)
- Bahamas
- Barbados
- Belize
- Bermuda
- Brasil
- Virgin Islands, British
- Cayman Islands
- Chile (Español)
- Colombia (Español)
- Costa Rica (Español)
- Dominica
- República Dominicana
- Ecuador (Español)
- El Salvador (Español)
- Grenada
- Guatemala (Español)
- Guyana
- Honduras (Español)
- Jamaica
- México
- Montserrat
- Nicaragua (Español)
- Panamá
- Paraguay (Español)
- Perú
- St.
 Kitts and Nevis
Kitts and Nevis - Saint Lucia
- St. Vincent and The Grenadines
- Suriname
- Trinidad and Tobago
- Turks and Caicos
- Uruguay (English)
- Venezuela (Español)
- Canada (English)
- Canada (Français)
- United States
- Estados Unidos (Español México)
- الولايات المتحدة
- США
- 美国 (简体中文)
- États-Unis (Français France)
- 미국
- Estados Unidos (Português Brasil)
- Hoa Kỳ
- 美國 (繁體中文台灣)
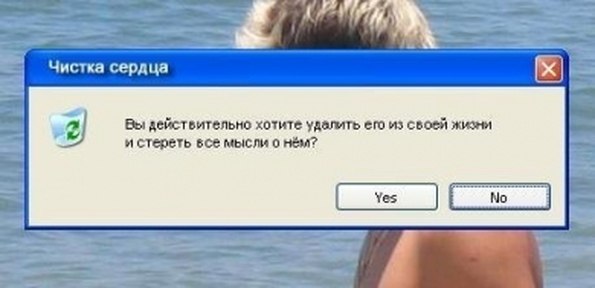
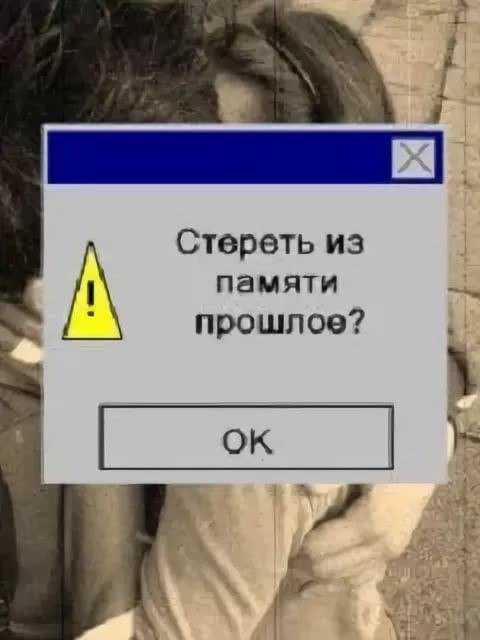
Можно ли целенаправленно стереть человеку память?
В медицинской практике нередко встречаются случаи, когда пациенты теряют память. Можно ли с помощью современных технологий избирательно стереть определенные воспоминания?
Теги:
Мозг
Авария
Технологии
Мозг человека — сложный орган с миллиардами клеток, соединенных между собой триллионами связей. Мы еще далеко не до конца понимаем, как устроен наш мозг и, в частности, как работает наша память. Ясно одно: память — не записная книжка, а динамическая изменяющаяся структура, на которую влияет каждое новое действие или ощущение, запомненное нами.
Мы еще далеко не до конца понимаем, как устроен наш мозг и, в частности, как работает наша память. Ясно одно: память — не записная книжка, а динамическая изменяющаяся структура, на которую влияет каждое новое действие или ощущение, запомненное нами.
Содержание статьи
Не занимайтесь самолечением! В наших статьях мы собираем последние научные данные и мнения авторитетных экспертов в области здоровья. Но помните: поставить диагноз и назначить лечение может только врач.
Забыть все невозможно
В результате физической или психической травмы, алкоголизма и ряда других причин может наступить амнезия. В зависимости от типа этого заболевания человек может забывать события из жизни до начала болезни, терять способность запоминать информацию, не помнить то, что случилось несколько минут назад и так далее. Пока что надежного способа вернуть человеку воспоминания или избирательно стереть их, у ученых нет.
Эксперименты идут
Однако, исследователи уже смогли избирательно стереть память морской улитке аплизии. Ученые выяснили, что увеличение силы соединения между нейронами для ассоциативной и неассоциативной памяти управляется с помощью двух разных молекул. Блокируя одну из молекул, исследователи смогли избирательно стереть воспоминания, связанные с образованием синаптических связей одного из нейронов. Однако, по словам ученых, требуются дополнительные клинические испытания, чтобы точно определить, какие лекарственные препараты смогут ослабить неассоциативную память.
Ученые выяснили, что увеличение силы соединения между нейронами для ассоциативной и неассоциативной памяти управляется с помощью двух разных молекул. Блокируя одну из молекул, исследователи смогли избирательно стереть воспоминания, связанные с образованием синаптических связей одного из нейронов. Однако, по словам ученых, требуются дополнительные клинические испытания, чтобы точно определить, какие лекарственные препараты смогут ослабить неассоциативную память.
Химическая деинтеллектуализация
Другая работа, опубликованная в журнале Science Advances, показывает возможность стирания памяти с помощью анестетика пропофола. У всех людей была запланирована операция, перед которой им должны были внутривенно вводить этот препарат. За неделю до операции всем им показывали истории в виде слайд-шоу с негативной окраской: в одной шла речь про мальчика, который попал в автомобильную аварию, а в другой — про женщину, на которую ночью напали преступники.
РЕКЛАМА – ПРОДОЛЖЕНИЕ НИЖЕ
Перед самой операцией им напомнили про истории и испытуемые их отчетливо вспомнили. После операции и спустя сутки после того, как добровольцы отошли от наркоза, их еще раз спросили про подробности историй, которые им показывали. Оказалось, что участники намного хуже помнят негативно окрашенные моменты историй. Все это значит, что некоторые негативные воспоминания все же можно, если не стереть, но очень сильно заглушить. Такие методы «заглушения» воспоминаний могут помочь для лечения посттравматического стрессового расстройства.
youtube
Нажми и смотри
Еще по теме:
9 способов поддержать вашу память в отличном состоянии. Видео
Как стереть память и восстановить ее
Исследователи из Медицинской школы Калифорнийского университета в Сан-Диего стерли и повторно активировали воспоминания у крыс, коренным образом изменив реакцию животных на прошлые события.
Исследование, опубликованное 1 июня в расширенном онлайн-выпуске журнала Nature , впервые продемонстрировало возможность выборочного удаления воспоминаний и предсказуемой реактивации их путем стимуляции нервов в мозге на частотах, которые, как известно, ослабляют и укрепляют связи между нервными клетками, называемые синапсами.
«Мы можем формировать память, стирать эту память и по желанию реактивировать ее, применяя стимул, который выборочно усиливает или ослабляет синаптические связи», — сказал старший автор Роберто Малинов, доктор медицинских наук, профессор кафедры неврологии. и секция нейробиологии Отделения биологических наук.
Ученые оптически стимулировали группу нервов в мозгу крысы, которая была генетически модифицирована, чтобы сделать их чувствительными к свету, и одновременно наносили электрический удар по ноге животного. Крысы вскоре научились ассоциировать стимуляцию зрительного нерва с болью и проявляли страх при стимуляции этих нервов.
Анализы показали химические изменения в синапсах оптически стимулированных нервов, свидетельствующие об усилении синапсов.
На следующем этапе эксперимента исследовательская группа продемонстрировала способность ослаблять эту схему, стимулируя те же самые нервы стирающей память низкочастотной серией оптических импульсов. Эти крысы впоследствии больше не реагировали на первоначальную нервную стимуляцию страхом, что позволяет предположить, что память, связанная с болью, была стерта.
Возможно, самым поразительным открытием исследования стало то, что ученые обнаружили, что могут повторно активировать утраченную память путем повторной стимуляции тех же нервов формирующей память высокочастотной серией оптических импульсов. Эти рекондиционированные крысы снова реагировали на первоначальную стимуляцию страхом, даже несмотря на то, что их ноги не подвергались повторному удару током.
«Мы можем заставить животное испытывать страх, а затем не бояться, а затем снова испытывать страх, стимулируя нервы на частотах, которые усиливают или ослабляют синапсы», — сказал Садег Набави, научный сотрудник лаборатории Малинова. ведущий автор.
ведущий автор.
Что касается потенциальных клинических применений, Малинов, заведующий кафедрой Shiley Endowed в исследованиях болезни Альцгеймера в честь доктора Леона Таля, отметил, что бета-амилоидный пептид, который накапливается в мозге людей с болезнью Альцгеймера, ослабляет синаптические связи во многих случаях. так же, как низкочастотная стимуляция стирала воспоминания у крыс. «Поскольку наша работа показывает, что мы можем обратить вспять процессы, ослабляющие синапсы, мы потенциально можем противодействовать некоторым эффектам бета-амилоида у пациентов с болезнью Альцгеймера», — сказал он.
Соавторы: Рокки Фокс и Кристоф Пру, Департамент неврологии UCSD; и Джон Лин и Роджер Циен, Департамент фармакологии Калифорнийского университета в Сан-Франциско.
Это исследование частично финансировалось Национальным институтом здравоохранения (гранты MH049159 и NS27177) и Фондом лечения болезни Альцгеймера.
# # #
Контакт для СМИ: Scott LaFee, 619-543-6163, slafee@ucsd. edu
edu
Как стереть в памяти следы боли и страха
1. Бланшар Р.Дж., Бланшар Д.К. Приседание как показатель страха . Дж. Комп. Физиол. Психол. 1969;67:370–375. [PubMed] [Google Scholar]
2. Wilson H.D. Взаимосвязь между базальным уровнем тревожности и аффективной реакцией на воспаление. Физиол. Поведение 2007; 90: 506–511. [PubMed] [Google Scholar]
3. Фрот М. Половые различия в восприятии боли и тревоги. Психофизическое исследование местного применения капсаицина. Боль. 2004; 108: 230–236. [PubMed] [Google Scholar]
4. Киф Ф. Дж. Психологические аспекты постоянной боли: современное состояние науки. Дж. Боль. 2004; 5:195–211. [PubMed] [Google Scholar]
5. Руди Дж. Л., Мигер М. В. Страх и тревога: различные эффекты на болевой порог человека. Боль. 2000; 84: 65–75. [PubMed] [Google Scholar]
6. Леду Дж. Э. Цепи эмоций в мозге. Анну. Преподобный Нейроски. 2000; 23: 155–184. [PubMed] [Google Scholar]
7. Фиддик Л. Больше, чем миндалевидное тело: оценка потенциальной угрозы в поясной коре. Неврологи. Биоповедение. 2011; 35:1007–1018. [PubMed] [Google Scholar]
Неврологи. Биоповедение. 2011; 35:1007–1018. [PubMed] [Google Scholar]
8. Sotres-Bayon F., Quirk G.J. Префронтальный контроль страха: больше, чем просто угасание. Курс. мнение Нейробиол. 2010;20:231–235. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Рейнвиль П. Мозговые механизмы болевого аффекта и модуляция боли. Курс. мнение Нейробиол. 2002; 12: 195–204. [PubMed] [Google Scholar]
10. Wiech K. Нейрокогнитивные аспекты восприятия боли. Тенденции Познан. науч. 2008; 12: 306–313. [PubMed] [Google Scholar]
11. Стауд Р. Активность мозга, связанная с временной суммацией С-волокон, вызывающих боль. Боль. 2007; 129:130–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Плогхаус А. Отделение боли от ее ожидания в человеческом мозгу. Наука. 1999;284:1979–1981. [PubMed] [Google Scholar]
13. Платон Б. Высокочастотная высокоинтенсивная чрескожная электрическая стимуляция нервов в лечении боли после хирургического аборта. Боль. 2010; 148:114–119. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
14. Sandkühler J. Продолжительное обезболивание после ЧЭНС и акупунктуры: спинальные механизмы вне контроля ворот. В: Девор М., редактор. Материалы 9-го Всемирного конгресса по боли. ИАСП Пресс; 2000. С. 359–369. [Google Scholar]
15. Клейдон Л.С. Дозоспецифические эффекты чрескожной электрической стимуляции нервов (ЧЭНС) на экспериментальную боль: систематический обзор. клин. Дж. Боль. 2011; 27: 635–647. [PubMed] [Академия Google]
16. Dowswell T. Чрескожная электрическая стимуляция нервов (ЧЭНС) для обезболивания родов. Кокрановская система баз данных. Версия 2009: CD007214. [PMC бесплатная статья] [PubMed] [Google Scholar]
17. Sandkühler J. Модели и механизмы гипералгезии и аллодинии. Физиол. 2009; 89: 707–758. [PubMed] [Google Scholar]
18. Чу Л.Ф. Опиоид-индуцированная гипералгезия у людей: молекулярные механизмы и клинические аспекты. клин. Дж. Боль. 2008; 24: 479–496. [PubMed] [Академия Google]
19. Чанг Г. Толерантность к опиоидам и гипералгезия. Мед. клин. Север Ам. 2007;91:199–211. [PubMed] [Google Scholar]
Толерантность к опиоидам и гипералгезия. Мед. клин. Север Ам. 2007;91:199–211. [PubMed] [Google Scholar]
20. Дрдла Р. Индукция синаптической долговременной потенциации после отмены опиоидов. Наука. 2009; 325: 207–210. [PubMed] [Google Scholar]
21. Дабле Л. Дж. Нейропатическая боль как процесс: изменение хронизации в модели животных. Дж. Пейн Рез. 2011;4:315–323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Итон М. Дж. Однократная интратекальная инъекция ГАМК навсегда купирует невропатическую боль после повреждения нерва. Мозг Res. 1999;835:334–339. [PubMed] [Google Scholar]
23. Франклин М.Е., Фоа Э.Б. Лечение обсессивно-компульсивного расстройства. Анну. Преподобный Клин. Психол. 2011;7:229–243. [PubMed] [Google Scholar]
24. Стробер М. Патологическая обусловленность страхом и нервная анорексия: в поисках новых парадигм. Междунар. Дж. Ешьте. Беспорядок. 2004; 35: 504–508. [PubMed] [Google Scholar]
25. Сакко Т., Саккетти Б. Роль вторичной сенсорной коры в хранении и воспроизведении эмоциональной памяти у крыс. Наука. 2010;329: 649–656. [PubMed] [Google Scholar]
Наука. 2010;329: 649–656. [PubMed] [Google Scholar]
26. Бутон М.Е. Контекст и поведенческие процессы в условиях исчезновения. Учиться. Мем. 2004; 11: 485–494. [PubMed] [Google Scholar]
27. Надер К., Хардт О. Единый стандарт памяти: случай реконсолидации. Нац. Преподобный Нейроски. 2009; 10: 224–234. [PubMed] [Google Scholar]
28. Ли Дж. Л. Реконсолидация: поддержание актуальности памяти. Тренды Нейроси. 2009; 32: 413–420. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Дрдла-Шуттинг Р. Стирание следа боли в памяти позвоночника кратковременным введением высоких доз опиоидов. Наука. 2012; 335: 235–238. [PubMed] [Академия Google]
30. Ху СЗ. Ингибирование синтеза белка блокирует позднюю фазу LTP вызванных потенциалов поля C-волокон в задних рогах спинного мозга крысы. Дж. Нейрофизиол. 2003; 89: 2354–2359. [PubMed] [Google Scholar]
31. Millecamps M. D-циклосерин снижает нейропатическую боль через лимбическую цепь, опосредованную NMDA. Боль. 2007; 132:108–123. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Боль. 2007; 132:108–123. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Антал А., Паулюс В. Случай рефрактерной орофациальной боли, которую лечили с помощью транскраниальной стимуляции постоянным током, применяемой к двигательной области руки в сочетании с приемом препарата агониста NMDA. Мозговой стимул. 2011;4:117–121. [PubMed] [Академия Google]
33. Millan M.J., Seguin L. Химически разнообразные лиганды в сайте глицина B, связанные с рецепторами N-метил-D-аспартата (NMDA), избирательно блокируют позднюю фазу боли, вызванной формалином, у мышей. Неврологи. лат. 1994; 178:139–143. [PubMed] [Google Scholar]
34. Мигес П.В. PKMz поддерживает память, регулируя GluR2-зависимую транспортировку AMPA-рецепторов. Нац. Неврологи. 2010;13:630–634. [PubMed] [Google Scholar]
35. Шема Р. Быстрое стирание ассоциаций долговременной памяти в коре с помощью ингибитора ПКМ z. Наука. 2007;317:951–953. [PubMed] [Google Scholar]
36. Сактор Т.К. Как ПКМз поддерживает долговременную память? Нац. Преподобный Нейроски. 2011; 12:9–15. [PubMed] [Google Scholar]
Преподобный Нейроски. 2011; 12:9–15. [PubMed] [Google Scholar]
37. Квапис Дж. Л. Протеинкиназа Mz поддерживает память о страхе в миндалевидном теле, но не в гиппокампе. Поведение Неврологи. 2009; 123:844–850. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Парсонс Р.Г., Дэвис М. Временное нарушение испуга, потенцированного страхом, после ингибирования PKMz в миндалевидном теле. Нац. Неврологи. 2011;14:295–296. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Marchand F. Специфическое участие атипичных PKCz/PKMz в стойкой ноцицептивной обработке позвоночника после периферического воспаления у крыс. Мол. Боль. 2011;7:86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Laferrière A. PKMz необходим для пластичности позвоночника, лежащей в основе поддержания постоянной боли. Мол. Боль. 2011;7:99. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Асиэду М.Н. Спинальная протеинкиназа Mz лежит в основе поддерживающего механизма стойкой ноцицептивной сенсибилизации. Дж. Нейроски. 2011; 31:6646–6653. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Нейроски. 2011; 31:6646–6653. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Ли X-Y. Облегчение невропатической болевой гиперчувствительности путем ингибирования PKMz в передней части поясной извилины. Наука. 2010; 330:1400–1404. [PubMed] [Google Scholar]
43. Кинг Т. Вклад PKMz-зависимой и независимой амплификации в компоненты экспериментальной невропатической боли. Боль. 2012; 153:1263–1273. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Gao Y-J., Ji R-R. Хемокины, нейронально-глиальные взаимодействия и центральная обработка невропатической боли. Фармакол. тер. 2010; 126:56–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. McMahon S.B., Malcangio M. Текущие проблемы биологии глиальной боли. Нейрон. 2009;64:46–54. [PubMed] [Google Scholar]
46. Sandkühler, J. Пластичность позвоночника и боль. In Wall and Melzack’s Textbook of Pain (6-е изд.) (Koltzenburg, M. and McMahon, S., eds), Elsevier Churchill Livingstone (в печати)
47. Loram L.C. Стойкое купирование невропатической боли путем однократной интратекальной инъекции агонистов аденозиновых рецепторов 2А: новая терапия нейропатической боли. Дж. Нейроски. 2009 г.;29:14015–14025. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Loram L.C. Стойкое купирование невропатической боли путем однократной интратекальной инъекции агонистов аденозиновых рецепторов 2А: новая терапия нейропатической боли. Дж. Нейроски. 2009 г.;29:14015–14025. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Ледебур А. Миноциклин ослабляет механическую аллодинию и экспрессию провоспалительных цитокинов в крысиных моделях облегчения боли. Боль. 2005; 115:71–83. [PubMed] [Google Scholar]
49. Coull J.A.M. Транссинаптический сдвиг градиента анионов в нейронах I спинномозговой пластинки как механизм нейропатической боли. Природа. 2003; 424: 938–942. [PubMed] [Google Scholar]
50. Coull J.A.M. BDNF из микроглии вызывает сдвиг градиента нейрональных анионов, лежащий в основе невропатической боли. Природа. 2005; 438:1017–1021. [PubMed] [Академия Google]
51. Morgado C. Миноциклин полностью устраняет механическую гипералгезию у крыс с диабетом за счет вызванных микроглией изменений в экспрессии котранспортера хлорида калия 2 (KCC2) в спинном мозге. Диабет Ожирение. Метаб. 2011;13:150–159. [PubMed] [Google Scholar]
Диабет Ожирение. Метаб. 2011;13:150–159. [PubMed] [Google Scholar]
52. Сигурдссон Т. Долговременная потенциация в миндалевидном теле: клеточный механизм обучения страху и памяти. Нейрофармакология. 2007; 52: 215–227. [PubMed] [Google Scholar]
53. Марен С. Синаптические механизмы ассоциативной памяти в миндалевидном теле. Нейрон. 2005; 47: 783–786. [PubMed] [Академия Google]
54. Вайва Г. Немедленное лечение пропранололом уменьшает посттравматическое стрессовое расстройство через два месяца после травмы. биол. Психиатрия. 2003; 54: 947–949. [PubMed] [Google Scholar]
55. Питман Р.К. Пилотное исследование вторичной профилактики посттравматического стрессового расстройства с помощью пропранолола. биол. Психиатрия. 2002; 51: 189–192. [PubMed] [Google Scholar]
56. Холбрук Т.Л. Употребление морфина после боевого ранения в Ираке и посттравматического стрессового расстройства. Н. англ. Дж. Мед. 2010; 362:110–117. [PubMed] [Академия Google]
57. Брайант Р.А. Изучение защитной функции острого введения морфина при последующем посттравматическом стрессовом расстройстве. биол. Психиатрия. 2009; 65: 438–440. [PubMed] [Google Scholar]
Брайант Р.А. Изучение защитной функции острого введения морфина при последующем посттравматическом стрессовом расстройстве. биол. Психиатрия. 2009; 65: 438–440. [PubMed] [Google Scholar]
58. McGhee L.L. Влияние пропранолола на посттравматическое стрессовое расстройство у военнослужащих, получивших ожоги. J. Burn Care Res. 2009; 30:92–97. [PubMed] [Google Scholar]
59. Штейн М.Б. Фармакотерапия для предотвращения посттравматического стрессового расстройства: результаты рандомизированного контролируемого исследования для подтверждения концепции у пациентов с физическими травмами. J. Травматический стресс. 2007;20:923–932. [PubMed] [Google Scholar]
60. Serrano P. Стойкое фосфорилирование протеинкиназой M z поддерживает позднюю фазу долговременного потенцирования. Дж. Нейроски. 2005; 25:1979–1984. [PMC free article] [PubMed] [Google Scholar]
61. Пасталькова Е. Хранение пространственной информации механизмом обслуживания LTP. Наука. 2006; 313:1141–1144. [PubMed] [Google Scholar]
62. Serrano P. PKMz поддерживает пространственные, инструментальные и классически обусловленные долговременные воспоминания. PLoS биол. 2008;6:2698–2706. [PMC free article] [PubMed] [Google Scholar]
Serrano P. PKMz поддерживает пространственные, инструментальные и классически обусловленные долговременные воспоминания. PLoS биол. 2008;6:2698–2706. [PMC free article] [PubMed] [Google Scholar]
63. Сьерра-Меркадо Д. Диссоциативные роли прелимбической и инфралимбической коры, вентрального гиппокампа и базолатеральной миндалевидного тела в выражении и угашении условного страха. Нейропсихофармакология. 2011; 36: 529–538. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Volk LJ PKM-z не требуется для синаптической пластичности, обучения и памяти гиппокампа. Природа. 2013; 493:420–423. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Ясумацу Н. Принципы многолетней динамики дендритных шипиков. Дж. Нейроски. 2008; 28:13592–13608. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Эверитт Б. Дж. Аппетитивное поведение: влияние зависимых от миндалевидного тела механизмов эмоционального обучения. Анна. Н. Я. акад. науч. 2003; 985: 233–250. [PubMed] [Google Scholar]
67. Надер К. Воспоминания о страхе требуют синтеза белка в миндалевидном теле для реконсолидации после извлечения. Природа. 2000;406:722–726. [PubMed] [Академия Google]
Надер К. Воспоминания о страхе требуют синтеза белка в миндалевидном теле для реконсолидации после извлечения. Природа. 2000;406:722–726. [PubMed] [Академия Google]
68. Дойер В. Специфическая для синапсов реконсолидация отчетливых воспоминаний о страхе в латеральной миндалине. Нац. Неврологи. 2007; 10: 414–416. [PubMed] [Google Scholar]
69. Ли Дж. Л. Реконсолидация и угасание условного страха: торможение и потенциация. Дж. Нейроски. 2006; 26:10051–10056. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Debec J., LeDoux J.E. Нарушение реконсолидации, но не консолидация слухового страха, обусловленного норадренергической блокадой в миндалевидном теле. Неврология. 2004;129: 267–272. [PubMed] [Google Scholar]
71. Киндт М. За гранью вымирания: стирание реакции человеческого страха и предотвращение возвращения страха. Нац. Неврологи. 2009; 12: 256–258. [PubMed] [Google Scholar]
72. Brunet A. Реактивация травмы под влиянием пропранолола уменьшает симптомы и расстройства посттравматического стресса: 3 открытых исследования. Дж. Клин. Психофармак. 2011; 31: 547–550. [PubMed] [Google Scholar]
Дж. Клин. Психофармак. 2011; 31: 547–550. [PubMed] [Google Scholar]
73. Монфис М.Х. Границы угасания-реконсолидации: ключ к стойкому ослаблению воспоминаний о страхе. Наука. 2009 г.;324:951–955. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Шиллер Д. Предотвращение возвращения страха у людей с помощью механизмов обновления реконсолидации. Природа. 2010; 463:49–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Киндт М., Сотер М. Реконсолидация в исследовании обусловленности человеческого страха: проверка угасания как механизма обновления. биол. Психол. 2011;92:43–50. [PubMed] [Google Scholar]
76. Сотер М., Киндт М. Нарушение реконсолидации: фармакологические и поведенческие манипуляции. Учиться. Мем. 2011;18:357–366. [PubMed] [Академия Google]
77. Мартинс И. Реверсия нейропатической боли путем снижения уровня норадреналина, опосредованного ВПГ-1, в области мозга, способствующей боли. Боль. 2010; 151:137–145. [PubMed] [Google Scholar]
78. Льюис С.С. (+)-налоксон, опиоидно-неактивный ингибитор передачи сигналов толл-подобного рецептора 4, устраняет несколько моделей хронической нейропатической боли у крыс. Дж. Боль. 2012; 13: 498–506. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Льюис С.С. (+)-налоксон, опиоидно-неактивный ингибитор передачи сигналов толл-подобного рецептора 4, устраняет несколько моделей хронической нейропатической боли у крыс. Дж. Боль. 2012; 13: 498–506. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Zeilhofer H.U. Быстрое синаптическое торможение в сенсорной обработке позвоночника и контроле над болью. Физиол. Ред. 2012;92: 193–235. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Knabl J. Реверсия патологической боли с помощью определенных подтипов спинальных GABA A рецепторов. Природа. 2008; 451:330–334. [PubMed] [Google Scholar]
81. Абрахам А.Д. Метилфенидат усиливает угасание контекстуального страха. Учиться. Мем. 2012;19:67–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Грэм Б.М., Ричардсон Р. Фактор роста фибробластов-2 усиливает угасание и уменьшает возобновление условного страха. Нейропсихофармакология. 2010; 35:1348–1355. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Уокер Д.Л. Облегчение условно-рефлекторного угасания страха при системном введении или инъекциях D-циклосерина внутрь миндалевидного тела, что оценивалось по вздрагиваниям, потенцированному страхом, у крыс. Дж. Нейроски. 2002; 22: 2343–2351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Уокер Д.Л. Облегчение условно-рефлекторного угасания страха при системном введении или инъекциях D-циклосерина внутрь миндалевидного тела, что оценивалось по вздрагиваниям, потенцированному страхом, у крыс. Дж. Нейроски. 2002; 22: 2343–2351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Леджервуд Л. Влияние D-циклосерина на угасание условного замирания. Поведение Неврологи. 2003; 117: 341–349. [PubMed] [Google Scholar]
85. Леджервуд Л. D-циклосерин и облегчение угасания условного страха: последствия восстановления. Поведение Неврологи. 2004; 118: 505–513. [PubMed] [Академия Google]
86. Ресслер К.Дж. Когнитивные усилители в качестве дополнения к психотерапии: использование D-циклосерина у людей с фобиями для облегчения угасания страха. Арка Общая психиатрия. 2004;61:1136–1144. [PubMed] [Google Scholar]
87. Хофманн С.Г. Расширение экспозиционной терапии D-циклосерином при социальном тревожном расстройстве. Арка Общая психиатрия. 2006; 63: 298–304. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
88. Гуастелла А.Дж. Рандомизированное контролируемое исследование D-циклосерина, усиливающего экспозиционную терапию социального тревожного расстройства. биол. Психиатрия. 2008; 63: 544–549.. [PubMed] [Google Scholar]
89. Отто М. В. Эффективность d-циклосерина для усиления ответа на когнитивно-поведенческую терапию панического расстройства. биол. Психиатрия. 2010;67:365–370. [PubMed] [Google Scholar]
90. Кушнер М.Г. Терапия с усиленным воздействием D-циклосерина при обсессивно-компульсивном расстройстве. биол. Психиатрия. 2007; 62: 835–838. [PubMed] [Google Scholar]
91. Вильгельм С. Расширение поведенческой терапии с помощью D-циклосерина при обсессивно-компульсивном расстройстве. Являюсь. Дж. Психиатрия. 2008; 165:335–341. [PubMed] [Академия Google]
92. Гуастелла А.Дж. Рандомизированное контролируемое исследование влияния D-циклосерина на экспозиционную терапию при боязни пауков. Дж. Психиатр. Рез. 2007; 41: 466–471.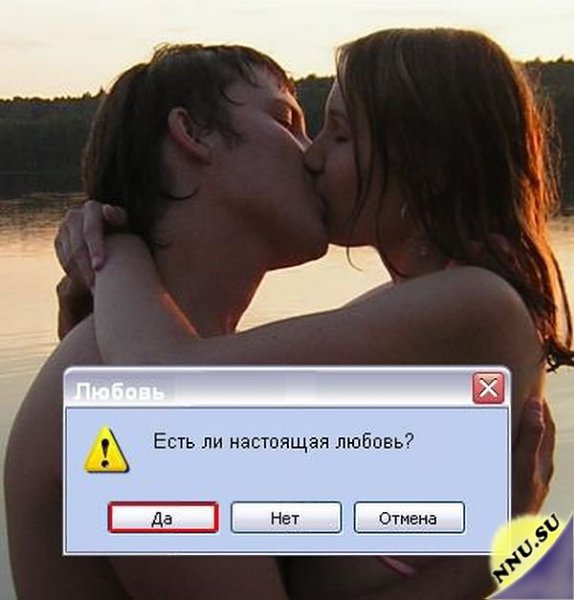 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
93. Литц Б.Т. Рандомизированное плацебо-контролируемое исследование D-циклосерина и экспозиционной терапии при посттравматическом стрессовом расстройстве. Дж. Психиатр. Рез. 2012;46:1184–1190. [PubMed] [Google Scholar]
94. де Кляйне Р.А. Рандомизированное плацебо-контролируемое исследование D-циклосерина для улучшения экспозиционной терапии посттравматического стрессового расстройства. биол. Психиатрия. 2012;71:962–968. [PubMed] [Google Scholar]
95. Лэнгтон Дж. М., Ричардсон Р. D-циклосерин способствует угасанию в первый раз, но не во второй раз: исследование роли NMDA в ходе повторяющихся сеансов угасания. Нейропсихофармакология. 2008;33:3096–3102. [PubMed] [Google Scholar]
96. Блисс Т.В.П., Коллингридж Г.Л. Синаптическая модель памяти: долговременная потенциация в гиппокампе. Природа. 1993; 361:31–39. [PubMed] [Google Scholar]
97. Керчнер Г.А., Николл Р.А. Молчащие синапсы и появление постсинаптического механизма LTP.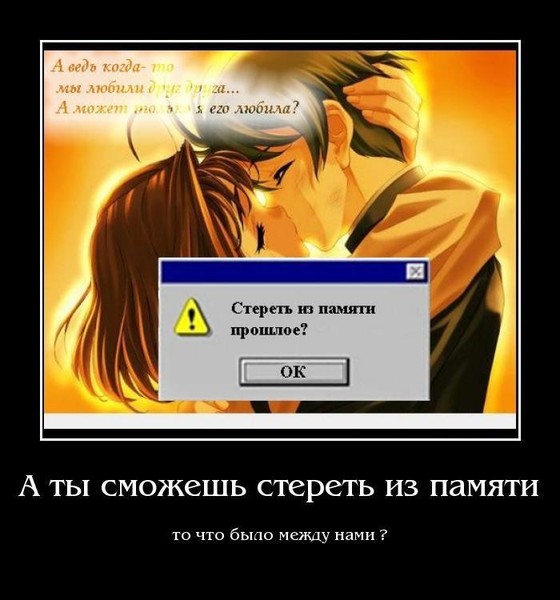 Нац. Преподобный Нейроски. 2008;9: 813–825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нац. Преподобный Нейроски. 2008;9: 813–825. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Лисман Дж. Э. Дебаты до и после LTP. Нейрон. 2009; 63: 281–284. [PubMed] [Google Scholar]
99. Шафе Г.Е. Консолидация памяти павловского кондиционирования страха: клеточная и молекулярная перспектива. Тренды Нейроси. 2001; 24: 540–546. [PubMed] [Google Scholar]
100. Шафе Г.Э., Леду Дж.Э. Консолидация памяти слухового павловского условного рефлекса страха требует синтеза белка и протеинкиназы А в миндалевидном теле. Дж. Нейроски. 2000;20:RC96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Николс М.Л. Передача хронической ноцицепции спинномозговыми нейронами, экспрессирующими рецептор вещества Р. Наука. 1999; 286:1558–1561. [PubMed] [Google Scholar]
102. Zhuo M. Пластичность коры головного мозга как новое измерение конечной точки хронической боли. Мол. Боль. 2011;7:54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Икеда Х. Синаптическая пластичность в проекционных нейронах спинной пластинки I, которые опосредуют гипералгезию. Наука. 2003;299:1237–1240. [PubMed] [Google Scholar]
Синаптическая пластичность в проекционных нейронах спинной пластинки I, которые опосредуют гипералгезию. Наука. 2003;299:1237–1240. [PubMed] [Google Scholar]
104. Икеда Х. Синаптический усилитель воспалительной боли в спинном дорсальном роге. Наука. 2006; 312:1659–1662. [PubMed] [Google Scholar]
105. Bonicalzi V., Canavero S. Фармакологическое лечение невропатической боли: текущее состояние и будущие направления. Терапия. 2006; 3: 651–677. [Google Scholar]
106. Чжоу Л-Дж. Ограниченный BDNF способствует тому, что повреждение кожных афферентов не приводит к невропатической боли. Боль. 2010; 148:148–157. [PubMed] [Академия Google]
107. Чжоу Л-Дж. Нейротрофический фактор головного мозга способствует долговременной потенциации спинного мозга и механической гиперчувствительности путем активации микроглии спинного мозга у крыс. Мозговое поведение. Иммун. 2011;25:322–334. [PubMed] [Google Scholar]
108. Гонг Q-J. АТФ индуцирует долговременную потенциацию полевых потенциалов, вызванных С-волокнами, в задних рогах спинного мозга: роль рецепторов P2X 4 и p38 MAPK в микроглии. Глия. 2009; 57: 583–591. [PubMed] [Google Scholar]
Глия. 2009; 57: 583–591. [PubMed] [Google Scholar]
109. Ян Х-В. Активация спинальных D1/D5 рецепторов индуцирует позднюю фазу LTP вызванных потенциалов поля c-волокон в задних рогах спинного мозга крысы. Дж. Нейрофизиол. 2005;94:961–967. [PubMed] [Google Scholar]
110. Ruscheweyh R. Длительное потенцирование ноцицептивных путей позвоночника как новая цель терапии боли. Мол. Боль. 2011;7:20. [PMC free article] [PubMed] [Google Scholar]
111. Wang Y. Дифференциальные роли фосфорилированных субъединиц GluR1 рецептора AMPA в участках Serine-831 и Serine-845 в задних рогах спинного мозга в крысиной модели послеоперационной боли . Нейрохим. Рез. 2011; 36: 170–176. [PubMed] [Google Scholar]
112. Luo C. Пресинаптически локализованная циклическая GMP-зависимая протеинкиназа 1 является ключевым детерминантом спинальной синаптической потенциации и гиперчувствительности к боли. PLoS биол. 2012;10:e1001283. [Бесплатная статья PMC] [PubMed] [Google Scholar]
113. Романский Л.М. Соматосенсорная и слуховая конвергенция в латеральном ядре миндалины. Поведение Неврологи. 1993; 107: 444–450. [PubMed] [Google Scholar]
Романский Л.М. Соматосенсорная и слуховая конвергенция в латеральном ядре миндалины. Поведение Неврологи. 1993; 107: 444–450. [PubMed] [Google Scholar]
114. Clugnet MC, LeDoux J.E. Синаптическая пластичность в цепях кондиционирования страха: индукция LTP в латеральном ядре миндалевидного тела путем стимуляции медиального коленчатого тела. Дж. Нейроски. 1990; 10: 2818–2824. [Бесплатная статья PMC] [PubMed] [Google Scholar]
115. Doyère V. Длительная потенциация у свободно движущихся крыс выявляет асимметрию таламических и корковых входов в латеральную миндалину. Евро. Дж. Нейроски. 2003; 17: 2703–2715. [PubMed] [Академия Google]
116. Апергис-Шауте А.М. Слуховое обусловливание страха и долговременная потенциация в латеральной миндалине требуют передачи сигналов киназы ERK/MAP в слуховом таламусе: роль пресинаптической пластичности в системе страха. Дж. Нейроски. 2005; 25: 5730–5739. [Бесплатная статья PMC] [PubMed] [Google Scholar]
117. Марен С. Синтез белка в миндалевидном теле, но не в слуховом таламусе, необходим для консолидации павловского условного рефлекса страха у крыс.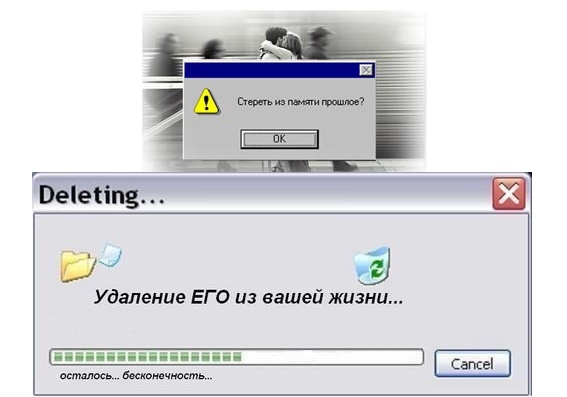 Евро. Дж. Нейроски. 2003;18:3080–3088. [PubMed] [Академия Google]
Евро. Дж. Нейроски. 2003;18:3080–3088. [PubMed] [Академия Google]
118. Бурчуладзе Р. Различные тренировочные процедуры задействуют один или два критических периода для консолидации контекстуальной памяти, каждый из которых требует синтеза белка и ПКА. Учиться. Мем. 1998; 5: 365–374. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Руди Дж. В., Матус-Амат П. Вентральный гиппокамп поддерживает представление в памяти контекста и контекстуальное обусловливание страха: последствия для унитарной функции гиппокампа. Поведение Неврологи. 2005; 119: 154–163. [PubMed] [Академия Google]
120. Коркоран К.А., Куирк Г.Дж. Активность прелимбической коры необходима для выражения выученных, но не врожденных страхов. Дж. Нейроски. 2007; 27: 840–844. [Бесплатная статья PMC] [PubMed] [Google Scholar]
121. Schwienbacher I. Временная инактивация прилежащего ядра нарушает приобретение и выражение потенцированного страхом испуга у крыс. Мозг Res. 2004; 1027:87–93. [PubMed] [Google Scholar]
122.
 Kitts and Nevis
Kitts and Nevis